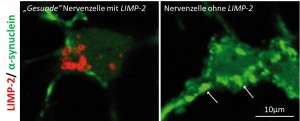
Wenn LIMP-2 (rot angefärbt) in Nervenzellen vorhanden ist, sammelt sich nicht so viel α-Synuclein (grün angefärbt) an. Im Gegensatz dazu sammelt sich in einer Zelle, aus der LIMP-2 experimentell entfernt wurde, viel α-Synuclein an.
© Biochemisches Institut, CAU
Wenn wichtige Prozesse in menschlichen Zellen nicht richtig funktionieren, kann das schwerwiegende Folgen haben. Bei der neurodegenerativen Erkrankung Parkinson etwa sammelt sich in den Nervenzellen das Protein α-Synuclein an, weil sein Abbau nicht optimal funktioniert. Wissenschaftler haben jetzt herausgefunden, wie sich der Transport und Abbau dieses Proteins steuern lassen könnte.
α-Synuclein ist ein kleines, wasserlösliches Protein im Gehirn von Wirbeltieren, das unter anderem für die Regulation der Dopamin-Ausschüttung verantwortlich ist. Bei Parkinson-Patienten sammelt sich dieses Protein in den Nervenzellen an. „Wir konnten zeigen, dass der Verlust von LIMP-2, eines Membranproteins des Lysosoms, die Ablagerungen von unlöslichem, fehlgefaltetem α-Synuclein im Gehirn begünstigt“, erklärt Judith Blanz an der Christian-Albrechts-Universität zu Kiel (CAU).
Lysosomen sind Zellorganellen, in denen defekte oder nicht länger benötigte größere Moleküle, wie zum Beispiel Fette, abgebaut werden. Dies Aufgabe erfüllen verschiedene Enzyme. Das Membranprotein LIMP-2 bindet ein solches Enzym, die β-Glucocerebrosidase, und transportiert es in das Lysosom. Fehlt LIMP-2, dann gelangt das Enzym nicht in die Lysosomen und kann dort seine Funktion nicht erfüllen. Als Folge lagern sich in den Lysosomen Fette ab, die verhindern, dass α-Synuclein abgebaut wird.
„Interessanterweise konnten wir feststellen, dass eine Erhöhung von LIMP-2 sich positiv auf den Abbau von α-Synuclein auswirkt“, erklärt die Biologin. Aber bevor man versucht gezielt in diesen zellulären Transportweg eingreifen müssen die Zusammenhänge in der Zelle noch besser erforscht werden. Als nächstes will die Wissenscfatlerin zusammen mit ihren Kollegen versuchen, die Bindung des Enzyms an das Transportprotein LIMP-2 so zu manipulieren, dass sich dies positiv auf den Abbau von α-Synuclein auswirkt. „Unsere Erkenntnisse eröffnen jetzt ganz neue Ansätze für die Behandlung von der Parkinson-Erkrankung.“
Christian-Albrechts-Universität zu Kiel (CAU), 13.10.2014.
Originalpublikation:
LIMP-2 expression is critical for β-glucocerebrosidase activity and α-synuclein clearance, Michelle Rothaug et al., PNAS, Oktober 2014. in press

