Für die Abwehr einer Infektion ist das Immunsystem zuständig. Dabei muss es in einem ersten Schritt erkennen, ob tatsächlich Eindringlinge vorhanden sind, wie etwa Bakterien oder ob es sich um Zellen des eigenen Körpers handelt. Sonst würde es im schlimmsten Fall nur eigenes Gewebe zerstören. Die Unterscheidung von Fremd und Selbst geschieht mithilfe von Strukturen, die jede Zelle auf ihrer Oberfläche trägt. Nun konnten Wissenschaftler ein molekulares Muster identifizieren das diesem Erkennungsmechanismus zugrunde liegt und dessen Funktionsweise aufklären. Eine Schlüsselrolle kommt dabei der Sialinsäure zu.
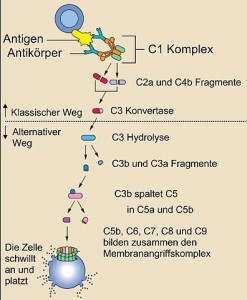
Das Komplementsystem besteht aus etwa 25 Proteinen, die gemeinsam die Immunreaktion von Antikörpern ergänzen (komplementieren), um so Bakterien zu zerstören. Komplement-Proteine zirkulieren in einer inaktiven Form im Blut. Wenn das erste Protein der Komplement-Kaskade aktiviert wird – typischerweise durch einen Antikörper, der an ein Antigen gebunden hat – kommt es zu einem Domino-Effekt: Jede Komponente aktiviert die nächste in einer Kette von Schritten, die als Komplement-Kaskade bezeichnet wird. Alle Komplementproteine zusammen bilden einen Zylinder in der Membran der Zielzelle, der ein Loch in der Zellmembran bildet. Dies führt zum Austausch von Molekülen und Flüssigkeit zwischen Zellinnerem und Umgebung, so dass die Zelle anschwillt an und platzt. © public domain.
Die auf menschlichen Zellen vorhandenen Erkennungsmuster bestehen aus komplexen, langenkettigen, teilweise verzweigten Zuckermolekülen, den sogenannten Glykanen. Der wichtigste Bestandteil dieser ‚Selbst’-Marker ist die Sialinsäure. Bereits Ende der 1970er Jahre fanden Forscher Hinweise dafür, dass die Sialinsäure für die Kontrolle des sogenannten Komplementsystems, eines Zweigs der angeborenen Immunabwehr, wichtig ist. Das Komplementsystem besteht aus einer Reihe von Proteinen, die im Blut zirkulieren. Sobald sie Bakterien erkannt haben heften sie sich auf deren Oberfläche an und aktivieren dort eine Reaktionskaskade, mit der sie die Zellwand der Eindringlinge durchlöchern, so dass diese platzen. Diese Kettenreaktion darf natürlich nur auf der Zelloberfläche von fremden Mikroorganismen aktiviert werden und keinesfalls auf der Oberfläche der eigenen Zellen. Wie die Sialinsäure das Komplementsystem bremsen könnte, damit es nicht die eigenen Zellen durchlöchert, war jedoch unklar.
Wissenschaftler von der Universität Tübingen gelang es nun einen Bindungskomplex zu identifizierten und kristallisierten, der die Kontaktstelle zwischen der Körperzelle und dem Immunsystem darstellt. Mit Hilfe von Kernresonanzspektroskopie und Röntgenstrukturanalyse konnten sie die molekulare Struktur des Komplexes aufklären. Er besteht aus sialinsäurehaltigen Glykanen und einem Regulator des Komplementsystems, der Faktor H genannt wird.
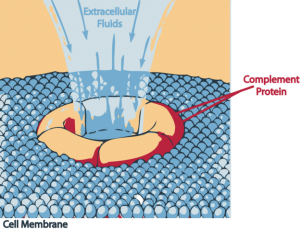
Der Membran-Angriffskomplex. © Brazucs. CC BY-SA 3.0.
„Auf körpereigenen Zellen verursacht die Erkennung der Sialinsäure durch Faktor H das Abbrechen der Komplementkaskade, so dass Zellen mit diesen Zuckerstrukturen unbeschädigt bleiben“, fasst Bärbel Blaum zusammen. Die Forscher vermuten, dass genau dieser Erkennungsmechanismus bei einer seltenen schweren Nierenerkrankung (atypisches hämolytisch-urämisches Syndrom – aHUS) gestört ist. „Aus genetischen Untersuchungen wissen wir, dass bei manchen aHUS Patienten ein Teil des Faktors H geschädigt ist, und es stellt sich nun heraus, dass diese Schädigung häufig die Sialinsäure-Bindestelle im Faktor H betrifft“, erklärt die Wissenschaftlerin. Die genaue Kenntnis der Struktur des Bindekomplexes wird den Forschern auch helfen, die Strategien mancher krankheitserregenden Bakterien besser zu verstehen. Diese entziehen sich nämlich einer Aktivierung des Komplementsystems, indem sie sich an der Sialinsäure-Bindestelle von Faktor H anheften und so dem Immunsystem vorgaukeln, dass sie nicht Fremd sind.
Universität Tübingen, 25.11.2014
Originalpublikation:
Bärbel S Blaum, Jonathan P Hannan, Andrew P Herbert, David Kavanagh, Dušan Uhrín & Thilo Stehle: Structural basis for sialic acid-mediated self-recognition by complement factor H. Nature Chemical Biology, DOI: 10.1038/nchembio.1696

