Illustration der Parkinson-Krankheit von Sir William Richard Gowers aus A Manual of Diseases of the Nervous System (Handbuch für Krankheiten des Nervensystems) von 1886. © public domain.
Bei der Parkinson-Krankheit sterben in einem bestimmten Gehirnareal allmählich immer mehr Dopamin-produzierende Nervenzellen. Forscher versuchen den Ursachen dieser Krankheit mit einem Mausmodell die Spur zu kommen. Sie versuchen Mäuse zu heilen, die nach einer Behandlung mit einer Substanz, die selektiv Dopamin-produzierende Nervenzellen tötet, Parkonsin-artige Symptome entwickeln. Wissenschaftler konnten nun an so behandelten Tieren erstmals zeigen, dass im Blut patroullierende Immunzellen ins Gehirn einwandern und dort maßgeblich an dem Absterben der Nervenzellen beteiligt sind. Mit einem Wirkstoff, der gegen ein Oberflächenmolekül auf diesen Entzündungszellen gerichtet war konnten die Forscher den Degenerationsprozess der Neuronen verlangsamen.
Ein kleiner Bereich des Mittelhirns, die sogenannte Substantia nigra, ist Schaltzentrale für alle Bewegungsabläufe unseres Körpers. Ein zunehmender Verlust an Dopamin-produzierenden Neuronen in diesem Gehirnareal führt daher zu den Kardinalsymptomen der Parkinson-Krankheit – Bewegungsarmut, Starre und Zittern.
Seit einigen Jahren häufen sich die wissenschaftlichen Indizien, dass entzündliche Veränderungen im Gehirn eine wesentliche Rolle bei Parkinson spielen. Ob diese Entzündungen nur von Immunzellen verursacht werden, die sich bereits im Gehirn befinden oder ob auch Zellen der angeborenen Immunabwehr, die aus dem dem Blut in das Gehirn einwandern, an den degenerativen Prozessen beteiligt sind, war bisher noch weitgehend unklar.
Das Team um Ana Martin Villalba am Deutschen Krebsforschungszentrum versucht die Ursachen des Zelltods bei Parkinson zu ergründen. Aufgrund ihrer bisherigen Forschungsarbeiten hatte die Neurowissenschaftlerin den Verdacht, dass ein bestimmtes Molekül des Fas-Systems am Nervensterben bei Parkinson beteiligt sein könnte: Der Fas-Ligand (FasL), der passgenau an den so genannten Todesrezeptor Fas andockt. Eine Bindung des Fas-Liganden an seinen Rezeptor führt zur Einleitung des programmierten Zelltodes, der Apoptose.
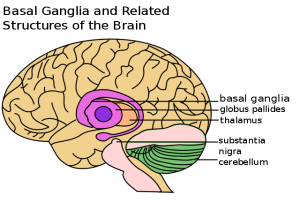
Der Verlust an Dopamin-produzierenden Nervenzellen in der Substantia nigra führt zu den Kardinalsymptomen der Parkinson-Krankheit – Bewegungsarmut, Starre und Zittern. Entzündungszellen der angeborenen Immunabwehr tragen zum Tod dieser Neuronen bei. © public domain.
Wie die Forscher vor kurzem zeigen konnten, lockt der Fas-Ligand die Immunzellen bei Rückenmarksverletzungen an den Ort der Wunde, wo die Zellen dann großen Schaden anrichten können. Nun wollten die Forscher prüfen, ob die peripheren Immunzellen womöglich auch bei chronischen neurodegenerativen Prozessen wie der Parkinson-Krankheit eine ähnlich verheerende Rolle spielen.
Um das Nervensterben an Mäusen zu untersuchen, bedienten sich die Wissenschaftler eines Modellsystems: Die chemische Substanz MPTP lässt selektiv Dopamin-produzierende Nervenzellen im Gehirn absterben. Die Tiere leiden dadurch an Parkinson-ähnliche Symptomen.
Mäusen, deren Immunzellen (Monozyten, Microglia) keinen Fas-Liganden bilden konnten, waren vor einem durch MPTP ausgelösten Nervensterben relativ gut geschützt. Immunzellen, die einen Fas-Liganden tragen sind also anscheinend am Tod der Nervenzellen mitschuldig. Schließlich wollten die Wissenschaftler noch klären, ob die im Gehirn ansässigen Fresszellen, Microglia-Zellen genannt, für diesen Effekt verantwortlich sind oder ob aus dem Blut ins Gehirn einwandernde Monozyten die wahren Verursacher sind.
Um diese Frage zu beantworten, bedienten sich die Forscher einer Substanz, die zwar den Fas-Liganden blockiert, nicht jedoch die Blut-Hirn-Schranke passieren kann. Diese Substanz wirkt also ausschließlich auf die Immunzellen im Blut, nicht aber auf die Microglia-Zellen im Gehirn. Mäuse, die mit dieser Substanz behandelt wurden, blieb der durch MPTP-induzierte Nervenzelltod ebenfalls erspart.
Damit konnten die Forscher erstmals nachweisen, dass die peripheren Zellen des angeborenen Immunsystems maßgeblich an der Neurodegeneration bei Parkinson beteiligt sind. Wobei dem Fas-Liganden eine Schlüsselrolle zukommt, da er die Zellen zum Entzündungsherd leitet.
Dabei könnte es im Gehirn zu einem sich selbst verstärkenden Teufelskreis kommen: Wenige Nervenzellen, die aus verschiedensten Gründen absterben, locken durch ihren Zerfall Immunzellen an, die dann ihrerseits durch die Bildung und Ausschüttung entzündungsfördernder Signalmoleküle das Nervensterben weiter vorantreiben.
Bisher sind die Hinweise darauf, dass diese an Mäusen gewonnenen Ergebnisse auch bei der Parkinson-Krankheit des Menschen eine Rolle spielen nur indirekter Natur. Kürzlich konnten die Forscher im Blut von Parkinson-Patienten eine erhöhte Anzahl entzündungsfördernder Monozyten nachweisen, die besonders reaktiv waren. Wobei die Anzahl der Zellen mit dem Grad der Krankheitssymptome korrelierte. Bisher wissen die Forscher jedoch noch nicht, ob diese Immunzellen, wie bei den Parkinson-Mäusen, in das Gehirn der Patienten einwandern und dort am Untergang der Neuronen beteiligt sind.
Sollte sich diese Vermutung bewahrheiten, dann könnte eine rechtzeitige Blockade des Fas-Liganden die Parkinson-Symptome abmildern. Der dafür notwendige Wirkstoff wurde bereits in klinischen Studien der Phase 2 geprüft. Er könnte also in ein paar Jahren für die Behandlung von Parkinson-Patienten zur Verfügung stehen. Möglicherweise könnte er sich auch noch bei anderen neurodegenerativen Krankheiten las hilfreich erweisen: Denn herbeigelockte Zellen des peripheren Immunsystems könnten auch für das Nervenzellsterben bei anderen neurodegenerativen Krankheiten, wie etwa Alzheimer, verantwortlich sein.
Deutsches Krebsforschungszentrum (DKFZ), 01.04.2015
Originalpublikationen:
Gao L., D. Brenner, E. Llorens-Bobadilla, G. Castro-Saiz , T. Frank, P. Wieghofer, O. Hill, M. Thiemann, S. Karray, M. Prinz, J. Weishaupt, and A. Martin-Villalba. Infiltration of circulating myeloid cells through CD95L contributes to neurodegeneration in mice. Journal of Experimental Medicine 2015, DOI: 10.1084/jem.20132423.
Grozdanov, V., C. Bliederhaeuser, W.P. Ruf, V. Roth, K. Fundel-Clemens, L. Zondler, D. Brenner, A. Martin-Villalba, B. Hengerer, J. Kassubek, A.C. Ludolph, J.H. Weishaupt, and K.M. Danzer: Inflammatory dysregulation of blood monocytes in Parkinson’s disease patients. Acta Neuropathol. 2014, DOI:10.1007/s00401-014-1345-4.
Letellier E, Kumar S, Sancho-Martinez I, Krauth S, Funke-Kaiser A, Laudenklos S, Konecki K, Klussmann S, Corsini NS, Kleber S, Drost N, Neumann A, Lévi-Strauss M, Brors B, Gretz N, Edler L, Fischer C, Hill O, Thiemann M, Biglari B, Karray S, Martin-Villalba A. CD95-ligand on peripheral myeloid cells activates Syk kinase to trigger their recruitment to the inflammatory site. Immunity. 2010 Feb 26;32(2):240-52. doi: 10.1016/j.immuni.2010.01.011. Epub 2010 Feb 11.

