© dkfz.de
Viele altersbedingte Krankheiten, wie Alzheimer oder Parkinsons, aber auch Stoffwechselstörungen können mit Proteinaggregaten einher gehen. Doch diese können in gesunden, jungen Zellen von Reparatursystemen wieder aufgelöst werden. Wissenschaftler haben nun in einem künstlichen System entschlüsselt, wie Proteinmoleküle in einem mehrstufigen Prozess aus den Verklumpungen herausgelöst werden.
In allen Zellen – vom Bakterium bis zum Menschen – werden Proteine als lange Ketten miteinander verknüpfter Aminosäuren hergestellt. Komplexe zelluläre Mechanismen sorgen dafür, dass die neu synthetisierten Proteine ihre gewünschte dreidimensionale Struktur annehmen, damit sie ihre Aufgaben erfüllen können. Schadhafte Proteine können sich teilweise entfalten und damit ihre richtige Struktur verlieren. Dabei besteht die Gefahr, dass sie mit anderen defekten Proteinen verklumpen. Wenn sich solche Aggregate in großer Menge bilden, kann das die Zellen dauerhaft schädigen oder sogar zum Zelltod führen. Viele neurodegenerative Erkrankungen, wie etwa Alzheimer und Parkinson, aber auch Stoffwechselstörungen können mit der Bildung solcher Proteinverklumpungen einher gehen. Sie sind jedoch auch allgemein an den verschiedensten Alterungsprozessen beteiligt.
Proteine verklumpen etwa, wenn die Proteinstruktur durch Mutationen gestört ist oder wenn chemische oder umweltbedingte Stressoren auftreten. Dazu zählt auch ein Anstieg der Umgebungstemperatur.
Bislang war wenig darüber bekannt, wie das natürliche Abwehrsystem des Menschen das Verklumpen der Proteine in jungen gesunden Zellen wirksam rückgängig machen kann. „Aggregate von Proteinen aufzulösen, ist für die Zellen ein entscheidender Schritt, um schadhafte Proteine „wiederzuverwerten“ und sich vor Zellschädigungen zu schützen. Wir hatten mehrere Hinweise darauf, wer die Hauptbeteiligten sind, wussten aber nicht, wie der Prozess konkret abläuft“, sagt Nadinath Nillegoda vom Deutschen Krebsforschungszentrum. Die Forscher haben nun in einem künstlichen System untersucht, wie ein aus mehreren Komponenten aufgebauter Proteinkomplex Proteinaggregate wirksam auflösen könnte.
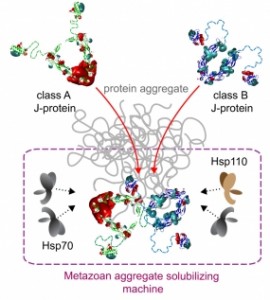
Dieser Komplex besteht aus molekularen Faltungshelfern, den Chaperonen, die zur Klasse der Hitzeschockproteine 70 (Hsp70) gehören. Sie helfen anderen Proteinen dabei sich richtig zu falten. Darüber hinaus enthält der Proteinkomplex Co-Chaperone, die die Aktivität der Hsp70-Proteine regulieren. Von zentraler Bedeutung sind hierfür die Co-Chaperone der sogenannten J-Proteinfamilie, die den Faltungshelfer Hsp70 an die Proteinaggregate „locken“ und dort zielgenau aktivieren. Wie die Forscher herausgefunden haben müssen zwei dieser J-Proteine miteinander interagieren, um den Faltungshelfer Hsp70 richtig zu aktivieren. Erst dann kann der aus mehreren Komponenten bestehende Proteinkomplex entstehen, der die Aggregate effektiv auslösen kann.
Wissenschaftler des Heidelberger Instituts für Theoretische Studien (HITS) übernahmen die Computeranalyse der Daten. Dazu entwickelten sie eine spezielle Modellierungsmethode, mit der sie die Bildung der Chaperonkomplexe simulieren konnten. Mit Hilfe dieses Modells konnten die Forscher die dynamischen Wechselwirkungen der beiden J-Proteintypen im Chaperonkomplex verstehen, welche die Aktivität aller Faltungshelferproteine koordinieren.
Ob dieser Proteinkomplex auch tatsächlich in lebenden Zellen vorkommt und wenn ja in welchen und welche Rolle er bei dem Abbau verklumpter Proteine im lebenden System spielt muss aber erst noch durch weitere Versuche geklärt werden.
Deutsches Krebsforschungszentrum, 12.08.2015
Originalpublikation:
N. B. Nillegoda, J. Kirstein, A. Szlachcic, M. Berynskyy, A. Stank, F. Stengel, K. Arnsburg, X. Gao, A. Scior, R. Aebersold, D. L. Guilbride, R. C. Wade, R. I. Morimoto, M. P. Mayer and Bernd Bukau: Crucial HSP70 co-chaperone complex unlocks metazoan protein disaggregation. Nature (published online 5 August 2015), doi: doi: 10.1038/nature14884

