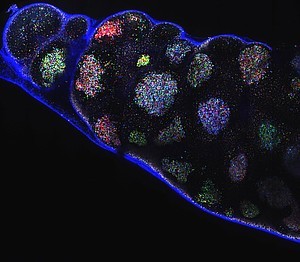
Lymphknoten einer infizierten Maus. Die verschiedenfarbigen Cluster sind Keimzentren mit unterschiedlichen Dominanz-Leveln © Gabriel D. Victora
Wenn ein Erreger in den Körper eindringt, bilden Immunzellen Antikörper, die den Eindringling anhand eines charakteristischen Merkmales – einem sogenannten Antigen – erkennen und bekämpfen. Im Verlaufe der Abwehrreaktion werden auch Gedächtniszellen gebildet. Sie sollen gewährleisten, dass unser Körper bei einem erneuten Kontakt mit dem gleichen Erreger schneller und stärker reagieren kann. Doch wie Forscher nun entdeckt haben, werden keineswegs nur Antikörper gebildet, die das Antigen auf dem Erreger passgenau erkennen. Vielmehr scheint unser Immunsystem mehr auf Variabilität und Flexibilität zu setzen, denn auf Perfektion.
Antikörper werden von weißen Blutkörperchen, den B-Zellen, gebildet, die ständig durch unseren Körper patrouillieren und nach Pathogenen Ausschau halten. Wenn eine B-Zelle mit ihrem Rezeptor ein Antigen auf einem Erreger erkennt, beginnt die Zelle entweder sofort damit den einigermaßen passenden Antikörper zu produzieren oder sie beteiligt sich an der Gründung eines Keimzentrums. Diese Zellansammlungen bilden sich, um die Antikörper passender B-Zellen zu vermehren und zu optimieren: Dabei modifizieren die Zellen ihre Antikörper durch Mutation, um sie anschließend durch Selektion zu optimieren. So nimmt mit der Zeit die Passgenauigkeit der Antikörper gegenüber dem Antigen immer mehr zu. Am Schluss dieses Prozesses, der Affinitätsreifung genannt wird, bleiben, so die gängige Theorie, nur die effektivsten Antikörper übrig.
Meyer-Hermann vom Helmholtz Zentrum für Infektionsforschung und sein Kollege Gabriel Victora vom Whitehead Institute for Biomedical Research in Cambridge, USA beschlossen diese Theorie zu überprüfen und herauszufinden, wie die Affinitätsreifung tatsächlich funktioniert. Dazu kombinierten die Forscher Einzelzellsequenzierungen mit Brainbow-Experimenten, einer in der Gehirn- und Entwicklungsforschung oft verwendete Methode. Dabei werden die Zellen nach einem Zufallsprinzip mit fluoreszierenden Proteinen markiert, die sie an ihre Tochterzellen weiter geben. „So lässt sich genau erkennen, welche Abstimmungslinie die Zellen haben und welche Gründerzellen ein Keimzentrum dominieren“, sagt Meyer-Hermann. „Nach dem bisherigen Erkenntnisstand gingen wir davon aus, dass nur wenige Zellen das Keimzentrum gründen und dass der starke Selektionsdruck zu einfarbigen Keimzentren führen sollte.“
Lymphozyt. © public domain.
Doch zur Überraschung der Forscher ergaben die Einzelzellsequenzierungen ein anderes Bild: „Bisher ging man von drei bis fünf Gründerzellen pro Keimzentrum aus. Wir haben jetzt gezeigt, dass es eher 100 sind“, sagt Meyer-Hermann. Und auch in den Brainbow-Experimenten erwiesen sich die Keimzentren als nicht so einfarbig, wie gedacht. Während einige Zentren im Laufe des Antikörperselektionsprozesses tatsächlich einfarbig wurden, bestanden andere selbst nach langer Zeit immer noch aus verschiedenen Farben. In diesen Zentren herrschte demnach nicht eine einzelne B-Zelllinie, mit einem einzigen, optimierten Antikörper vor, sondern es existierten viele verschiedene B-Zelllinien nebeneinander, die eine Vielzahl unterschiedlicher Antikörper bildeten.
Der Grund hierfür könnte darin liegen, dass es nicht immer vorteilhaft ist, sich perfekt auf einen Erreger einzustellen. Denn schließlich entwickeln sich diese ständig weiter. „Je spezifischer die Antikörper wirken, desto schlechter können sie auf Mutationen in den Pathogenen reagieren“, sagt Meyer-Hermann. „Eine gewisse Variabilität und Flexibilität könnte so entscheidend sein, um mit den sich ständig verändernden Pathogenen mitzuhalten“.
Langfristig könnten die Erkenntnisse bei der Entwicklung neuer Impfstoffe helfen. „Wenn wir wüssten, was das Verhältnis von klonal dominanten und diversen Keimzentren beeinflusst, könnten wir in Impfprotokollen die Diversität der induzierten Antikörper an die Mutationsgeschwindigkeit des Erregers anpassen“, sagt Meyer-Hermann.
Helmholtz Zentrum für Infektionsforschung, 19.02.2016
Originalpublikation:
Jeroen M.J. Tas, Luka Mesin, Giulia Pasqual, Sasha Targ, Johanne T. Jacobsen, Yasuko M. Mano, Casie S. Chen, Jean-Claude Weill, Claude-Agnès Reynaud, Edward P. Browne, Michael Meyer-Hermann, Gabriel D. Victora. Visualizing Antibody Affinity Maturation in Germinal Centers. Science. 2016 Feb 19. DOI: 10.1126/science.aad3439.

