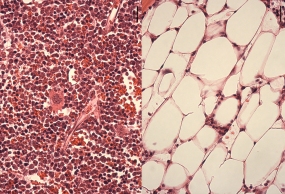
Nach einer Behandlung, die schlafende Blutstammzellen aufweckt: Das Knochenmark normaler Mäuse (links) ist vollgepackt mit Blutzellen verschiedener Reifestadien. Bei einer Maus mit dem Fanconi-Defekt dagegen führt diese Behandlung zum „Knochenmarksversagen“. Anstelle der Blutzellen haben sich Fettzellen angesiedelt. © Michael Milsom, DKFZ
Blutverlust, Infektionen, Entzündungen: Es sind die ganz alltäglichen Gesundheitsprobleme, die die Blutstammzellen im Knochenmark immer wieder aus ihrem Ruhezustand reißen und zur Teilung anregen. Bei den Zellteilungen kommt es immer wieder zu Fehlern bei der Verdopplung des Erbguts, die sich im Laufe der Zeit ansammeln. Das kann bei einer seltenen Erbkrankheit bis zum Versagen der Stammzellen führen, wie Wissenschaftler nun herausgefunden haben. Die Forscher zeigten an normalen Mäusen, wie es zu einer typischen altersbedingten Ansammlung von Mutationen kommt. Bei Mäusen mit einem defekten Erbgut-Reparatursystem führte die wiederholte Aktivierung der Blutstammzellen sogar zum völligen Versagen des Knochenmarks. Die Erbgutschädigungen stehen auch im Verdacht, Stammzellen zu Krebs entarten zu lassen.
Während der gesamten Lebensspanne erneuern und erhalten Stammzellen die Gewebe unseres Körpers. Solange kein Bedarf an Zell-Nachschub besteht, verharren sie in einem Ruhezustand. Das gilt auch für die blutbildenden Stammzellen in unserem Knochenmark. Während dieser Ruhephase teilen sie sich nicht und verbrauchen sehr wenig Energie.
Ereignisse, wie Blutverlust, Infektionen und Entzündungen, wecken die ruhenden Blutstammzellen auf. Dann beginnen sie unverzüglich mit der Zellteilung, um Nachschub zu produzieren, wie etwa Immunzellen für die Virenabwehr oder um einen Verlust an roten Blutkörperchen oder Blutplättchen zu kompensieren.
Das internationale Forscherteam um Michael Milsom vom Deutschen Krebsforschungszentrum vermutete, dass die Blutstammzellen in einem Ruhezustand verbleiben, solange sie nicht gebraucht werden, um sie vor DNA-Schäden und damit einem vorzeitigen Altern zu schützen. Um ihre Hypothese zu überprüfen untersuchten sie an Mäusen, ob Wecksignale tatsächlich zu DNA-Schäden führen.
Dazu behandelten die Forscher Mäuse mit einer Substanz, die ihrem Körper eine Virusinfektion vorgaukelt. Anschließend untersuchten sie die Blutstammzellen, die durch die vermeintliche Virusinfektion aus dem Ruhezustand geweckt worden waren und mit der Zellteilung begonnen hatten.
Um möglichst schnell viele Tochterzellen zu produzieren müssen die Blutstammzellen in kürzester Zeit von ihrem Ruhezustand auf maximale Aktivität umschalten. Dazu steigern sie ihre Stoffwechselaktivität massiv. Das erhöht jedoch die Wahrscheinlichkeit, dass es dabei zu Fehlern kommt.
Tatsächlich konnten die Wissenschaftler bei den aufgeweckten Stammzellen eine erhöhte Menge an schädlichen, reaktiven Stoffwechselprodukten nachweisen. Sie gelten als wichtige Ursache für DNA-Schäden.
Um dem entgegen zu wirken sind Stammzellen mit Reparatursystemen ausgestattet, die den größten Teil der DNA-Schäden wieder reparieren. Wenn die Zellen jedoch solchen Stressfaktoren zu häufig oder sogar chronisch ausgesetzt sind kann das Reparatursystem überlastet werden. Dies führt dazu, dass die Stammzellen mit zunehmendem Alter immer mehr Erbgutschäden ansammeln und schließlich versagen und sterben. „Unsere Versuche belegen, wie es zur Anhäufung von DNA-Schäden kommt. Damit können wir erklären warum die Regenerationsfähigkeit unserer Gewebe und Organe im Alter zurückgeht“, erläutert Milsom.
In Blutstammzellen mit eingeschränkter Reparaturkapazität, so vermuteten Milsom und seine Kollegen, müssten die Erbgutschädigung noch drastischere Auswirkungen haben, als in normalen Blutstammzellen. Daher untersuchten sie Mäuse mit einem defekten Reparatursystem. Beim Menschen führt dieser Defekt zur Fanconi-Anämie. Patienten, die von dieser Erbkrankheit betroffen sind, altern frühzeitig und ihr blutbildendes System stellt bereits in jungen Jahren den Zell-Nachschub ein, was auch als Knochenmarksversagen bezeichnet wird.
Die Fanconi-Mäuse wurden mit der Substanz behandelt, die dem Körper einen Virusinfekt vortäuscht. Normale Tiere verloren daraufhin einen Teil der Blutstammzellen im Knochenmark. Die Mäuse mit dem Reparaturdefekt waren nicht dazu in der Lage die stressinduzierten DNA-Schäden zu reparieren, was nach mehrmaligen Vortäuschen einer Vireninfektion zu einem kompletten Verlust aller Blutstammzellen führte. „Die Tiere zeigten genau die gleichen Symptome wie Patienten, die an einer Fanconi-Anämie leiden“, sagt Milsom.
Andreas Trumpp hält die Arbeit für entscheidend für das Verständnis von altersbedingten Krankheiten und Krebs: „Es sind die ganz normalen Gesundheitsbeschwerden, mit denen der Körper ein Leben lang ständig fertig werden muss, die die Blutstammzellen aus dem Schlaf reißen und in den Zellteilungszyklus zwingen: Blutverluste, Infektionen oder Entzündungen. Auf die Dauer gesehen führt das zu einem spürbaren Verschleiß der Blutstammzellen. Oder die DNA-Schäden lassen Stammzellen entarten und zum Saatkorn einer Krebserkrankung werden. Das ganz normale Leben lässt uns – und unsere Stammzellen – altern!“
Deutsches Krebsforschungszentrum (DKFZ), 18.02.2015
Originalpublikation:
Dagmar Walter, Amelie Lier, Anja Geiselhart, Frederic B. Thalheimer, Sina Huntscha, Mirko C. Sobotta, Bettina Moehrle, David Brocks, Irem Bayindir, Paul Kaschutnig, Katja Muedder, Corinna Klein, Anna Jauch, Timm Schroeder, Hartmut Geiger, Tobias P. Dick, Tim Holland-Letz, Peter Schmezer, Steven W. Lane, Michael A. Rieger, Marieke A. G. Essers, David A. Williams, Andreas Trumpp und Michael D. Milsom: Exit from dormancy provokes DNA damage-induced attrition in haematopoietic stem cells. Nature 2015, DOI: 10.1038/nature14131

