Forscher in den USA haben Lungenspühlungen von schwer erkrankten COVID-19 Patienten untersucht und Hinweise darauf gefunden, dass sich in den Lungen der Patienten ein Bradykinin-Sturm abspielte. Das Bradykinin-System ist unter anderem an der Förderung der Durchblutung nach Verletzungen beteiligt und gut untersucht. Falls die These der Forscher sich bestätigen sollte, würden wir bereits über Medikamente verfügen, mit denen wir die Symptome bekämpfen können.
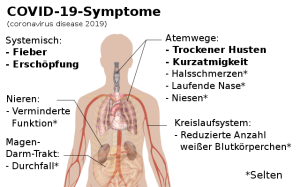
COVID-19-Symptome. © Bathyscapher. CC BY-SA 4.0. Wikimedia Commons.
Zu Beginn der COVID-19 Epidemie haben Forscher in China Lungenspühlungen an betroffenen Patienten durchgeführt, um in dieser Flüssigkeit das Virus zu identifizieren, das die Krankheit verursacht. Dabei sequenzierten sie alle RNAs, die sich in den Proben befanden. Also nicht nur die RNA-Sequenz des SARS-CoV-2 Virus sondern auch alle Abschriften der in diesem Lungenbereich gerade aktiven Gene. Die Daten dieser Genaktivitäten werteten nun Forscher um Daniel Jacobson am Oak Ridge National Laboratory aus, um herauszufinden, welchen Effekt die Vireninfektion auf genregulatorischer Ebene hat. Das heißt, sie wollten untersuchen, welche regulatorischen Netzwerke aktiviert wurden und für die heftigen Symptomen verantwortlich sind. Dabei fiel ihnen auf, dass die Konzentration des Angiotensin-konvertierendes Enzyms (kurz ACE) stark erniedrigt war. Dieses Enzym hält zusammen mit seinem Antagonisten ACE-2 einen normalen Blutdruck aufrecht und reguliert den Wasser-Elektrolyt-Haushalt unseres Körpers. ACE gehört zum Renin-Angiotensin-Aldosteron-Systems (RAAS) und erhöht in diesem Kontext den Blutdruck. Gleichzeitig inaktiviert ACE das Peptid Bradykinin. Wenn der ACE-Spiegel erniedrigt ist, wie bei den COVID-19 Patienten in der Lunge, dann sinkt der Blutdruck und Bradykinin kann seine Wirkung entfalten, indem es für ein Erschlaffen der glatten Muskulatur und ein Schmerzempfinden an der betroffenen Stelle sorgt.
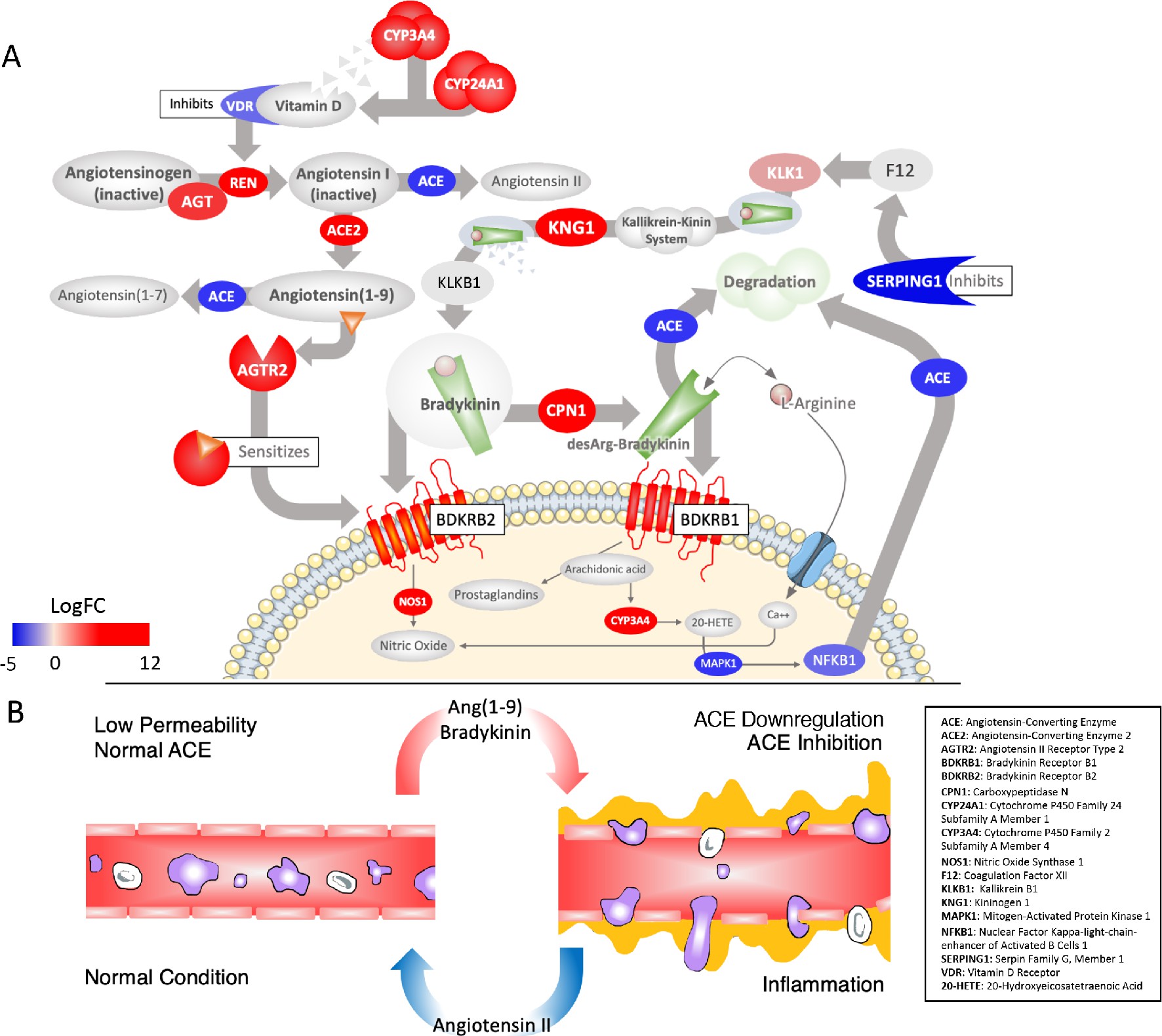
Bradykinin-Sturm.
(A) Rote Ovale: Gene, deren Expression bei COVID-19 deutlich erhöht ist. Blaue Ovale: herunterregulierte Gene. Das System wird durch die Produktion von Ang1-9 und AGTR2 in die Richtung einer Sensitivierung der Bradykinin-Rezeptoren die für Schmerzen (BDKRB1) zuständig sind und für eine NO-anhängige Blutgefäßerweiterung (BDKRB2) getrieben. Mehrere Faktoren sind für dieses Ungleichgewicht verantwortlich. Das Virus hemmt NFkappaB, so dass dieser nicht mehr an den ACE-Promotor binden und für dessen Trasnkription sorgen kann. Verminderung der Aktivierung von Vitamin D und seinem Rezeptor (VDR), was normalerweise die REN-Produktion hemmt und die gleichzeitige Hochregulation von ACE-2, was zu einer vermehrten Umwandlung von Angiotensin in Ang1-9 (oben links) führt. Eine Abnahme in der Expression des SERPING1 Gens, hebt die Hemmung von FXII aus der intrinsischen Koagulationskaskade auf, was zu einer vermehrten Produktion von Bradykinin aus seinen Vorläufern Kallikrein und KNG führt (beide hoch reguliert) (oben rechts). Die Bradykinin Werte sind weiter erhöht, weil der Wert von ACE, was diese normalerweise abbauen würde, erniedrigt ist. Ein Anstieg von Ang1-9 erhöht weiter den Effekt von Bradykinin am Rezeptor BDKRB2. Auch andere Enzyme, die Bradykinin abbauen sind herunterreguliert, wie etwa MME, das normalerweise Ang1-9, Bradykinin, und ein anderes wichtiges Peptid Apelin (APLN) abbaut. (B) Das Ergebnis eines hyperaktiven Bradykinin-Systems ist eine Erweiterung der Blutgefäße, was mit einem Austreten von Flüssigkeit ins Gewebe und einem Einwandern von Entzündugszellen verbunden ist. © eLife 2020;9:e59177 doi: 10.7554/eLife.59177
Gleichzeitig war die Menge an ACE-2, dem Gegenspieler von ACE, erhöht, so dass der Blutdruck weiter gesenkt wurde. ACE-2 ist auch die Eintrittspforte, über die SARS-CoV-2 in menschliche Zellen eindringt, die über dieses Enzym verfügen. Es ist also im Interesse des Virus, die ACE-2 Menge zu erhöhen, weil es dann mehr Eintrittspforten vorfindet, über die es immer neue Zellen infizieren kann. Das erreicht das Virus vermutlich über folgende Mechanismus: Es baut einen Faktor ab, der für das Ablesen des ACE-Gens verantwortlich ist. Dadurch ist die Menge an ACE Transkripten um das 10-fach erniedrigt. Da ACE normalerweise die Menge seines Antagonisten ACE-2 durch die Bildung von Angiotensin II hemmt kommt es in Gegenwart des Virus zu einer massiven Erhöhung von ACE-2, und zwar in den Lungenspühlungen um das 199-fache. Doch der Faktor, der für das Ablesen des ACE-Gens zuständig ist wird auch zum Ablesen des Immunreaktionen aktivierenden Gens Interferon gebraucht. Es kann also auch nicht genug Interferon gebildet werden. Damit hat das Virus gleich zwei Fliegen mit einer Klappe geschlagen.
Normalerweise bildet ACE durch seine enzymatische Aktivität in der Lunge verschiedene Angiotensin-Derivate, die für das Gleichgewicht des Blutdruck und Wasserhaushaltes im ganzen Körper zuständig sind. Wenn bei der Vireninfektion in der Lunge weniger ACE vorhanden ist und statt dessen ACE-2 massiv aktiviert wird, verschiebt sich die Balance des Systems in Richtung der Produktion von Angiotensin1-9, das die Aktivierung von Bradykinin im ganzen Körper bewirkt. So kommt es systemweit zu einem Austritt von Flüssigkeit aus den Blutgefäßen in das Gewebe und damit zu schmerzhaften Schwellungen. Das Phänomen ähnelt stark dem Quincke-Ödem, das auch als Nebenwirkung bei Patienten auftritt, die ACE-Hemmern als Blutdrucksenker einsetzen.
Menschen mit afrikanischen Wurzeln haben ein fünffach erhöhtes Risiko an Quinke-Ödem zu erkranken, weil sie eine erbliche Prädisposition für diese Erkrankung haben. Diese Tatsache würde erklären, warum in den USA so viele Menschen mit afrikanischen Wurzeln von der COVID-19 Erkrankung besonders schwer betroffen sind. Darüber hinaus soll Bradykinin der Grund für den trockenen Husten sein, den manche Patienten bei einer Therapie mit ACE-Hemmern entwickeln. Und Bradykinin bewirkt auch eine Kontraktion der Bronchial-, Darm- und Uterus-Muskeln. Im Darm kann dies zu Durchfall führen. Das würde erklären, warum manche an COVID-19 Erkrankte unter Durchfall leiden.
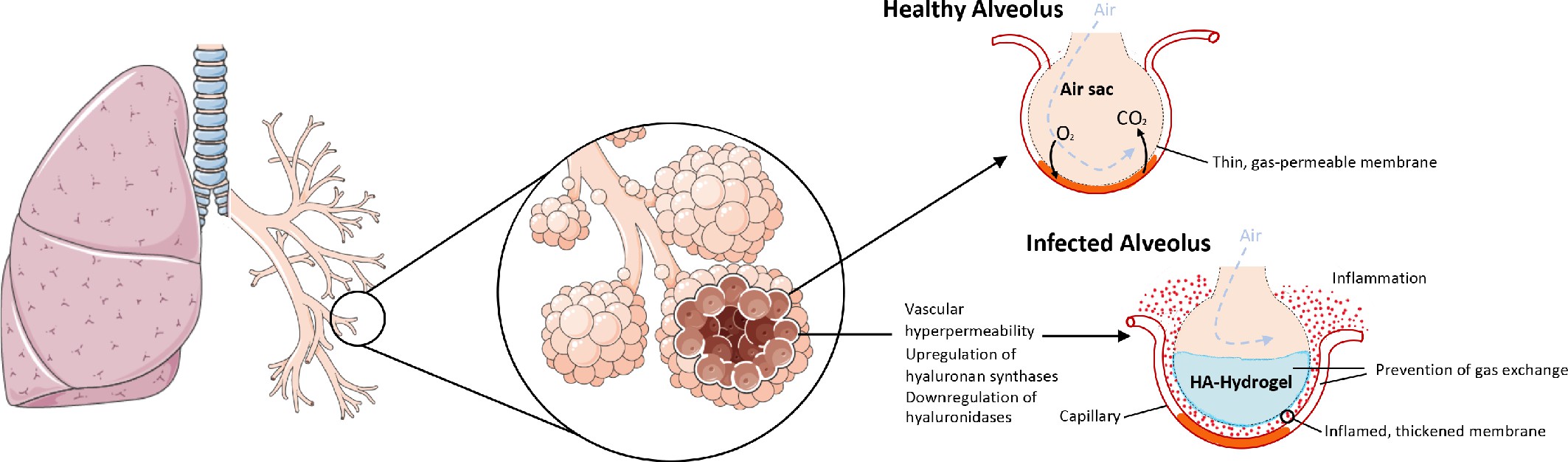
Bei COVID-19 ist in der Lunge die Hyaluronsäure bildende Hyaluron-Synthase erhöht und gleichzeitig die Hyaluronsäure abbauende Hyalurnidase erniedrigt. Dies führt zusammen mit der durch Bradykinin erhöhten Durchlässigkeit der Blutgefäße in der Lunge zur Bildung eines Hydrogels aus Hyaluronsäure, was den Gasaustausch in den Lungenalveolen bei COVID-19 Patienten hemmt. © eLife 2020;9:e59177 doi: 10.7554/eLife.59177
Weiter beobachteten die Forscher einen Anstieg von Hyaluronsäure, wobei gleichzeitig die Menge der Enzyme, die Hyaluronsäure abbauen können, erniedrigt war. Hyaluronsäure ist ein Bestandteil des Bindegewebes, der große Mengen an Wasser binden kann, aber auch als Schmiermittel dient. Im Zusammenhang mit dem stark erniedrigten Blutdruck in der Lunge entfaltet es dort eine fatale Wirkung. Denn wenn zu viel Flüssigkeit aus dem Blut in die Lunge eintritt und die Hyaluronsäure in den Lungenbläschen ein Hydrogel bildet das stark aufquillt, erschwert dies das Atmen ungemein und die Lunge nimmt gleichzeitig massiv an Gewicht zu. Bradykinin könnte also viele der Symptome erklären, die bei COVID-19 Patienten auftreten.
Darüber hinaus war auch das gefäßerweiterende Peptid Apelin (APLN) erhöht. Es kurbelt nicht nur die Bildung von ACE-2 an, sondern kann direkt die Kontraktion des Herzens beeinflussen und dort zu Rhythmusstörungen führen. In Kombination mit dem Bradykinin-Sturm könnte es für Herzprobleme verantwortlich sein, die bei einer COVID-19 Infektion auftreten können. Und die Zunahme an ACE-2 Rezeptoren im Herzen kann auch zu einer vermehrten Infektion dieses Organs durch das Virus führen. Aber auch ein durch den Bradykinin-Effekt hervorgerufener Kaliummangel kann zu Herzrhythmusstörungen und einem plötzlichen Herztod führen.
Wegen der zentralen Rolle, die ACE vermutlich bei COVID-19 spielt könnten Genvarianten, die für dieses Gen bekannt sind, möglicherweise eine wichtige Rolle spielen und für die Prognose der Erkrankung eingesetzt werden.
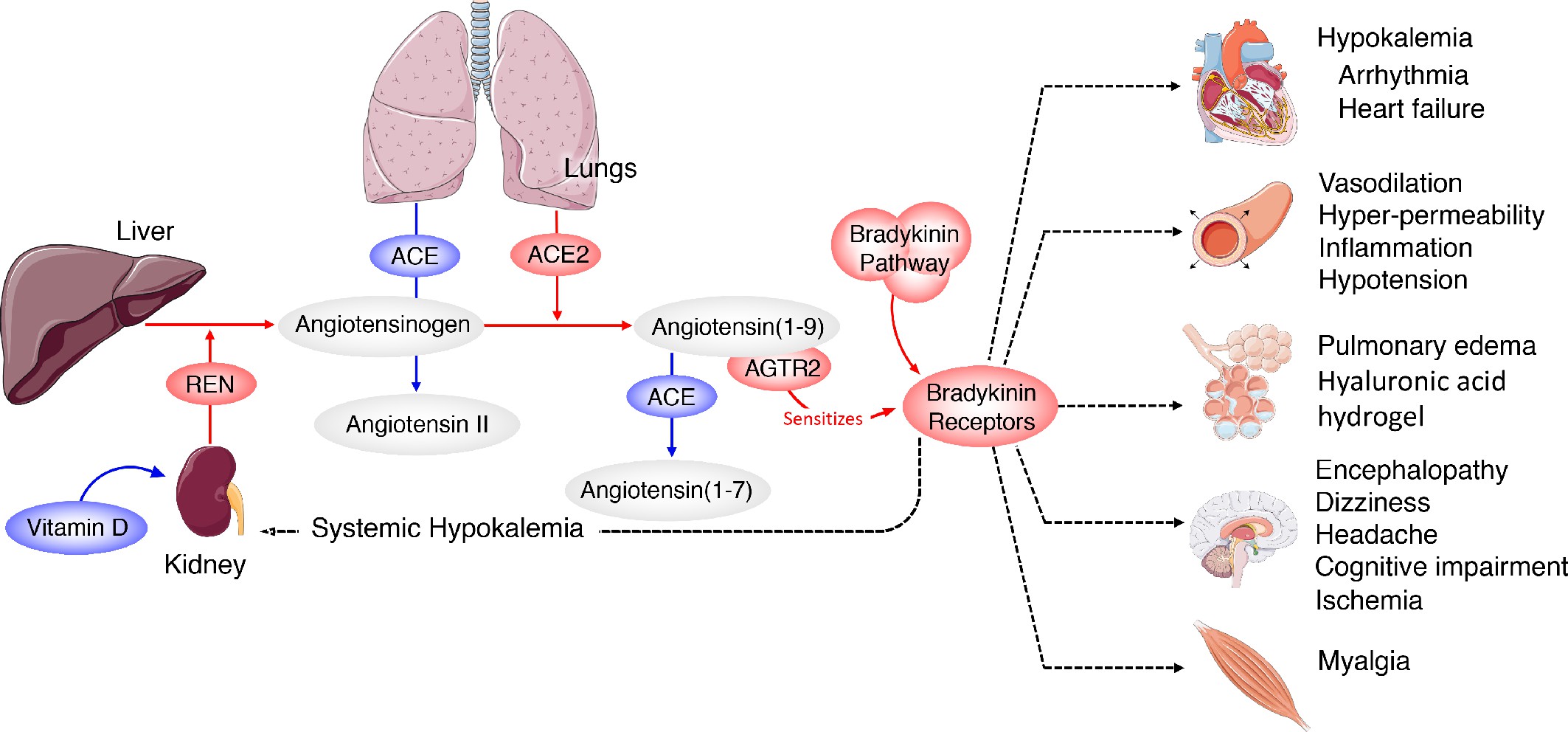
Wirkung eines aus dem Lot geratenen RAS und Bradykinin-Netzwerks auf den gesamten Körper.
Die Gen-Expressions-Muster von COVID-Lungespühlungen zeigen ein RAS, das in Richtung eines niedrigen ACE-Wertes verschoben ist. Das führt zu einem Anstieg des Ang1-9 Spiegels und von Bradykinin. Hohe Werte von ACE in der Lunge sorgen normalerweise für eine Bildung von Peptiden, die aus Angiotensin hergestellt sind und im ganzen Körper ihre Wirkung entfalten. Daher wird der Bradykinin-Sturm in der Lunge wahrscheinlich weitere wichtige Organe betreffen, die durch Angiotensin-Derivate reguliert werden. Dazu gehört ein veränderter Elektrolythaushalt der Nieren und des Herzgewebes, Rhythmusstörungen in dem deregulierten Herzgewebe, Neurologische Störungen im Gehirn, Muskelschmerzen und schwere Veränderung der Sauerstoffaufnahme in der Lunge selbst. Rot bedeutet Hochregulation und blau Herunterregulation. © eLife 2020;9:e59177 doi: 10.7554/eLife.59177
Da das RAAS System, was laut den Forschern für die massiven Effekte bei COVID-19 Erkrankungen verantwortlich ist, relativ gut untersucht ist verfügen wir möglicherweise bereits über Medikament, die wir für die Therapie erproben können. So ist etwa das Medikament Icatibant zur Behandlung akuter Attacken des Erblichen Angioödems zugelassen. Das nur aus zehn aminosäureähnlichen Bausteinen bestehende Peptid hat eine ähnliche Struktur wie Bradykinin und kann daher spezifisch an Bradykinin-B2-Rezeptoren binden. Auf diese Weise kann es die Bindung von Bradykinin an seinen Rezeptor verhindern und so dessen Wirkung hemmen. Ein anderes Medikament gegen das Erbliche Angioödem ist Ecallantid. Es hemmt das Enzyms Kallikrein, das im Kinin–Kallikrein System für die Freisetzung von Bradykinin von High-molecular weight kininogen (HMWK) sorgt. Die Autoren erwähnen noch ein paar andere Medikamente, deren Wirkung hier nicht weiter erläutert werden soll.
Alle diese möglichen Therapiekandidaten müssen jedoch erst noch in randomisierten Doppelblindstudien auf ihre Wirksamkeit getestet werden. Denn im Moment ist der Bradykinin-Sturm als Ursache für die COVID-19 Symptome nur eine unter vielen Hypothesen, die erst noch bestätigt werden muss.
Die Idee, ein Bradykinin-Sturm wäre die Ursache der Symptomen von COVID-19 ist nicht neu. Bereits im April diesen Jahren haben Forscher um Van de Veerdonk an der Radboud Universität in Nijmegen in den Niederlanden diese Hypothese geäußert und auf einem PrePrint-Server veröffentlicht. Inzwischen haben sie sogar bereits eine sehr kleine Studie durchgeführt, die Hoffnung weckt.
von Ute Keck, 18. September 2020
Originalpublikation:
Michael R Garvin, Christiane Alvarez, J Izaak Miller, Erica T Prates, Angelica M Walker, B Kirtley Amos, Alan E Mast, Amy Justice, Bruce Aronow, Daniel Jacobson. A mechanistic model and therapeutic interventions for COVID-19 involving a RAS-mediated bradykinin storm. eLife 2020; 9:e59177 doi: 10.7554/eLife.59177
Preprints: Kinins and Cytokines in COVID-19: A Comprehensive Pathophysiological Approach – Frank van de Veerdonk, Mihai G. Netea, Marcel van Deuren, Jos W.M. van der Meer, Quirijn de Mast, Roger J. Bruggemann, Hans van der Hoeven
https://www.preprints.org/manuscript/202004.0023/v1
van de Veerdonk FL, Kouijzer IJE, de Nooijer AH, et al. Outcomes Associated With Use of a Kinin B2 Receptor Antagonist Among Patients With COVID-19. JAMA Netw Open. 2020;3(8):e2017708. doi:10.1001/jamanetworkopen.2020.17708

