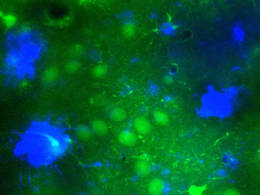
Mikroskopischer Einblick ins Alzheimer-Gehirn mit grün fluoreszierenden Nervenzellen in der Nähe der typischen Amyloid-Plaques (in blau dargestellt). © M. A. Busche / TUM
Bei Alzheimer-Kranken sammeln sich giftige Eiweißklumpen im Gehirn an, die die Nervenzellen schädigen. Als Auslöser für diesen Prozess gelten kleine Eiweißfragmente, die sogenannten Beta-Amyloid-Peptide, die von Enzymen aus einem Vorläufer-Protein herausgeschnitten werden. Nun haben Wissenschaftler einen weiteren wichtigen Stoffwechselweg entdeckt, der mit dem bisher bekannten in Konkurrenz steht. Bei diesem Weg schneiden Enzyme ein alternatives Eiweiß aus dem Vorläufer-Protein heraus. Die Tatsache, dass diese beiden Stoffwechselwege miteinander in Konkurrenz stehen könnte gravierende Konsequenzen für die Alzheimertherapie haben.
Die Forscher gaben dem neu entdeckten Peptid den Namen Amyloid-η (gesprochen: A(myloid)-Aeta). „Dieser Weg wurde 30 Jahre lang übersehen, weil sich Wissenschaftler weltweit mit den Entstehungsmechanismen des Beta-Amyloids auseinandergesetzt haben mit dem Ziel, dessen Produktion zu verhindern und so Alzheimer zu heilen“, sagt Christian Haass von der Universität München.
Bislang unbekannte Wechselwirkung entdeckt
„Wir haben in den letzten Jahren mikroskopische Verfahren entwickelt, mit denen wir die Wirkungen des neu entdeckten Aeta-Amyloids auf die Funktion einzelner Nervenzellen in vivo, d.h. im intakten Gehirn, analysieren konnten. Mit diesem experimentellen Ansatz hatten wir zuvor bereits herausgefunden, dass das lange bekannte Beta-Amyloid zu einer abnormen Zunahme von Hirnaktivität führt“, sagt Busche vom Klinikum der Technischen Universität München.
Gemeinsam gelang es dem internationalen Forscherteam, die Funktion des Aeta-Amyloids im Gehirn zu bestimmen: Während verklumptes Beta-Amyloid für Chaos sorgt, weil es Nervenzellen überaktiviert, bremst das Aeta-Amyloid die neuronale Stimulation. „Offenbar haben die zwei kleinen Eiweiße, die aus ein- und demselben Vorläuferprotein herausgeschnitten werden, gegensätzliche Wirkungen, die normalerweise genau austariert sind“, sagt Haass.
Diese Entdeckung hat einen direkten Einfluss auf derzeitige therapeutische Studien am Menschen, die sich bislang auf das Beta-Amyloid konzentrieren. So wird aktuell untersucht, ob die medikamentöse Unterdrückung der beta-Sekretase dazu führt, dass sich der Gedächtnisverlust bei Alzheimerpatienten verlangsamt. Dieses Enzym schneidet Beta-Amyloid aus einem Vorläufer-Protein heraus.
Wie die Forscher nun festgestellt haben führt die Blockade der beta-Sekretase zwar zu einer Reduktion von Beta-Amyloid. Gleichzeiitg hat diese aber auch eine massive Überproduktion von Aeta-Amyloid zur Folge. „Damit könnte es zu einer Störung der neuronalen Aktivität und damit der Gehirnfunktion kommen“, sagt Haass. Die Münchner Alzheimerforscher raten daher, solche bisher nicht erwarteten Nebenwirkungen in den klinischen Studien genau zu verfolgen.
Technische Universität München, 01.09.2015
Originalpublikation:
M. Willem, S. Tahirovic, M. A. Busche, S. V. Ovsepian, M. Chafai, S. Kootar, D. Hornburg, L. D.B. Evans, S. Moore, A. Daria, H. Hampel, V. Müller, C. Giudici, B. Nuscher, A. Wenninger-Weinzierl, E. Kremmer, M. T. Heneka, D. R. Thal, V. Giedraitis, L. Lannfelt, U. Müller, F. J. Livesey, F. Meissner, J. Herms, A. Konnerth, H. Marie & C. Haass, η-Secretase processing of APP inhibits neuronal activity in the hippocampus, Nature, August 2015.
DOI: 10.1038/nature14864

