TGF-ß. © public domain.
Bei vielen Autoimmunkrankheiten bilden B-Zellen des Immunsystems Antikörper, die sich gegen körpereigene Strukturen richten. Um die Entwicklung solcher selbst-reaktiven Antikörper zu verhindern wird die Reifung der B-Zellen streng kontrolliert. Wissenschaftler haben nun durch Experimente an Mäusen einen Mechanismus herausgefunden, der bei dieser Kontrolle eine wichtige Rolle spielt.
Die Entwicklung und Vermehrung der Antikörper-produzierenden B-Zellen wird von follikulären Helferzellen kontrolliert. Die Entwicklung der B-Zellen erfolgt in den Lymphknoten, der Milz und den Payer’schen Plaques, zusammenhängenden Ansammlungen von 10 bis 50 Lymphfollikeln, die im gesamten Dünndarm, im Krummdarm (Ileum) und im Wurmfortsatz vorkommen. Dort mischen sich die follikulären Helferzellen unter die sich teilenden und differenzierenden B-Zellen und fördern deren Wachstum. Wenn es jedoch zu einer zu hohen Ansammlung follikulärer Helferzellen in diesen Organen kommt können sich selbst-reaktiven B-Zellen bilden, die sich gegen körpereigene Strukturen wenden. Als Folge kann sich eine Autoimmunerkrankungen entwickeln.
Dr. Julien Marie und sein Team vom Deutschen Krebsforschungszentrum entdeckte nun, dass der transformierende Wachstumsfaktor ß (TGF-ß) die Ansammlung follikulärer Helferzellen und damit die Aktivierung selbst-reaktiver B-Zellen verhindern kann.
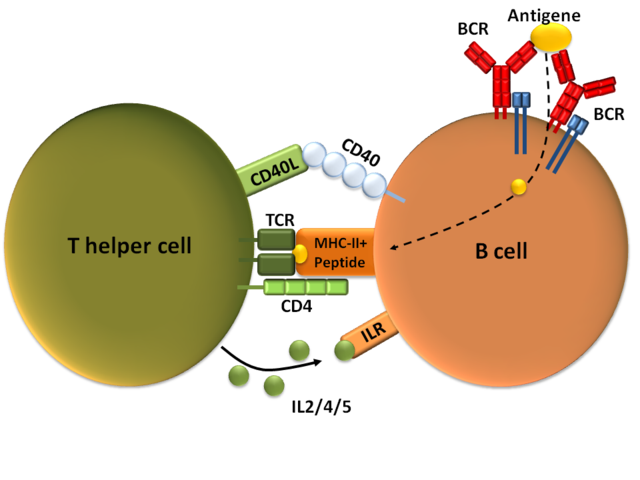
Eine B-Zelle wird durch eine T-Helferzelle aktiviert nachdem sie ihr das internalisierte Antigen als Peptid zusammen mit dem MHC-II-Komplex präsentiert hat. Weitere Bindungen erfolgen über den CD40-Rezeptor und seinen Ligand (CD40L), und über Interleukine (IL 2/4/5), die die T-Zelle ausschüttet. © public domain.
Für ihre Experimente untersuchten Marie und sein Team zwei verschiedene Mäusestämme: Den einen Mäusen fehlte der Wachstumsfaktor völlig. Ihre T-Zellen waren nicht dazu in der Lage TGF-ß zu produzieren. Die anderen Mäuse besaßen T-Zellen, die dauerhaft TGF-ß ausschütteten. Die Mäuse, die kein TGF-ß produzieren konnten entwickelten große Ansammlungen von follikulärer Helferzellen, eine übermäßige Zahl von B-Zellen in ihren Lymphknoten und der Milz, sowie selbst-reaktive Antikörper. Sie zeigten damit typische Symptome der Autoimmunerkrankung Lupus erythematosis. Wie die Wissenschaftler zeigen konnten geht die große Zahl von follikulären Helferzellen bei diesen Tieren auf ein Fehlen regulatorischer T-Zellen zurück. Normalerweise fördert der Wachstumsfaktor TGF-ß die Reifung dieser regulatorischen T-Zellen im Thymus. Diese wandern dann in die Lymphknoten, die Milz und die Payer’schen Plaques und lösen dort bei einigen der follikulären Helferzellen einen programmierten Zelltod (Apoptose) aus, um deren Anzahl zu kontrollieren. Bei follikulären Helferzellen, die dieser Kontrolle entgingen konnte keine Apoptose mehr eingeleitet werden. Sie schützen sich vor den apoptotischen Signalen der regulatorischen T-Zellen, indem sie in großen Mengen das antiapoptotisch wirkende Protein BCL-2 bildeten.
Die Experimente zeigen, dass dem Wachstumsfaktor TGF-ß eine zentrale Rolle bei der Aufrechterhaltung der B-Zell-Toleranz zukommt, indem er indirekt über die Reifung der regulatorischen T-Zellen die Zahl der follikulären Helferzellen begrenzt.
von Ute Keck
Mark J. McCarron and Julien C. Marie: TGF-ß prevents T follicular helper cell accumulation and B cell autoreactivity. Journal of Clinical Investigation 2014, DOI: 10.1172/JCI76179

