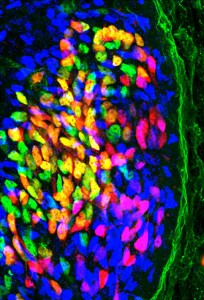
Während der Entwicklung schicken Nervenzellen (hier in blau, grün und gelb) ihre Axone zu bestimmten Beinmuskeln. Treffen die EphA4-Rezeptoren der auswachsenden Nervenzellen nicht mehr auf frei zugängliche Ephrine, finden die Fortsätze vieler Nervenzellen (violett) nicht mehr zu ihren Partnerzellen.
© MPI für Neurobiologie/ Gatto
Damit wir uns bewegen können, müssen sich unsere Nervenzellen mit unseren Muskelzellen oder anderen Nervenzellen verbinden. Auf ihrem Weg zum Ziel werden die auswachsenden Nervenfortsätze von einer Art „Verbotsschildern“ auf den Oberflächen anderer Zellen geleitet. Untersuchungen an Zellkulturen legten nahe, dass Protein-schneidende Enzyme, Proteasen genannt, diese Schilder sofort entfernen, sobald die wachsenden Nervenfortsätzen sie erkannt haben. So wird die „Erkennungsbindung“ zwischen Nervenfortsatz und Schild auf einer unterwegs angetroffenen anderen Zelle schneller getrennt und die Nervenfortsätze werden auf diese Weise schneller in Richtung ihres Zieles verwiesen. Wissenschaftler konnten nun im Tiermodell zeigen, dass Proteasen tatsächlich die Navigation von Nervenfortsätzen regulieren. Sie tun dies jedoch, anders als bisher angenommen, indem sie die Zahl der vorhandenen Schilder regulieren. Ohne Proteasen werden die Schilder verdeckt und die auswachsenden Nervenfortsätze werden fehlgeleitet. Die Ergebnisse erlauben, die Vernetzung von Nervenzellen während der Entwicklung zu verstehen und könnten auch für das Verständnis neurodegenerativer Erkrankungen, wie der Amyotrophen Lateralsklerose (ALS) relevant sein.
Das menschliche Gehirn enthält rund 100 Milliarden Nervenzellen. Jede einzelne dieser Nervenzellen vernetzt sich im Laufe der Embryonalentwicklung über einen langen Fortsatz, das Axon, mit anderen Nervenzellen. Manche dieser Axone müssen dabei weite Strecken durch den Körper navigieren, um etwa eine Verbindung zwischen Rückenmark und Bein herzustellen. Erst dadurch wird es uns möglich, so komplexe Bewegungsabläufe durchzuführen, wie etwa über eine Mauer zu balancieren.
Daher ist es für uns essenziell, dass sich die richtigen Nervenzellen miteinander verbinden. Doch wie findet ein Axon seinen Weg und die entsprechenden Partnernervenzellen unter Milliarden anderer Nervenzellen? „Wir kennen heute ein paar Dutzend Lenkungsmoleküle und ihre Rezeptoren, die zusammen Axonen bei der Orientierung helfen“, so Rüdiger Klein, Direktor am Max-Planck-Institut für Neurobiologie. Diese wenigen Rezeptor-Lenkungsmolekül-Paare steuern jedoch sehr viele Navigationsentscheidungen. „Es muss daher Mechanismen geben, die die Effekte dieser Proteinpaare verstärken und abwandeln“, überlegt Klein.
Rüdiger Klein und sein Team erforschen die Wegfindung von Nervenzellen während der Entwicklung. Im Fokus der Wissenschaftler stehen dabei die „Verbotsschilder“, die Ephrin Lenkungsmoleküle und ihre Eph-Rezeptoren. Ephrine und Eph-Rezeptoren befinden sich auf fast allen Zelloberflächen: sowohl auf den Axonen selbst, wie auf den Zellen des umgebenden Gewebes. Sie helfen den wachsenden Axonen dabei, ihren Weg und ihre Partnerzelle zu finden.
Wenn ein Axon durch den Körper wandert, dockt es immer wieder über das Ephrin/Eph-System an andere Zellen an, um herauszufinden, ob es schon am Ziel angekommen ist, oder ob es noch weiter wachsen muss. Durch diese Kontaktaufnahme werden in einer oder in beiden Zellen zelluläre Prozesse ausgelöst: In den meisten Fällen, nämlich dann, wenn das Axon seine Zielzelle noch nicht erreicht hat, führt das zu einer Trennung der Verbindung und einem gegenseitigen Abstoßen der Zellen. So wird das Axon auf seinem Weg zu seiner Zielzelle in die richtige Richtung gelenkt. Eine gängige Theorie besagt, dass diese Zellabstoßung durch Proteasen beschleunigt wird. Proteasen sind Enzyme, die Eph-Rezeptoren oder Ephrine abschneiden, und so die Verbindung zwischen den Zellen lösen können.
Protease beschleunigen die Zielfindung nicht, sondern so optimieren sie
Um diese Theorie zu überprüfen, untersuchten die Neurobiologen an Mäusen welchen Einfluss Proteasen auf die Geschwindigkeit der Zellabstoßung haben. Tatsächlich bestätigten die Versuche in Zellkultur die Theorie zunächst. „Im lebenden Organismus haben wir dagegen etwas ganz anderes gefunden“, berichtet Rüdiger Klein. Anders als erwartet war die Zellabstoßung bei Mäusen, deren EphA4-Rezeptor aufgrund einer genetischen Manipulation nicht durch Proteasen abgeschnitten werden konnte unverändert zuverlässig. Tiere, die jedoch den EphA4-Rezeptor weder auf den Axonen, noch auf dem umgebenden Gewebe mit Hilfe von Protease entfernen konnten hatten ein gravierendes Problem: Ihre Axone wuchsen in die falsche Richtung. Dadurch, dass die EphA4-Rezeptoren nicht durch Proteasen entfernt werden konnten reicherten sich diese immer mehr auf den Zelloberflächen des umgebenden Gewebes an. Der Grund hierfür: Die Rezeptoren binden an die auf der gleichen Zelloberfläche vorhandenen Ephrine. So werden die Ephrine „verdeckt“, die die auswachsenden Nervenfortsätze für ihre Orientierung dringend benötigen. Für die Eph-Rezeptoren der Axone blieben dann keine Verbotsschilder mehr übrig. Als Konsequenz wurden die Axone nicht mehr abgestoßen und fanden deshalb auch nicht mehr in ihre Zielgebiete.
Die Ergebnisse belegen, dass die Proteasen durch die Abspaltung der Eph-Rezeptoren nicht, wie erwartet, die Abstoßungsreaktion beschleunigen. Sie regulieren vielmehr die Anzahl der funktionstüchtigen Rezeptoren und indirekt die Zahl der frei zugänglichen Ephrine auf den Zellen, die als Navigationshilfen dienen. Ist das Gleichgewicht gestört, werden die auswachsenden Axone fehlgeleitet.
Dies ist eine wichtige Erkenntnis, denn EphA4-Rezeptoren haben essenzielle Funktionen während der Entwicklung von neuronalen Netzwerken im Gehirn und Rückenmark. Darüber hinaus werden sie mit neurodegenerativen Erkrankungen, wie der Amyotrophen Lateralsklerose (ALS) in Zusammenhang gebracht.
Max-Planck-Gesellschaft, 20. Oktober 2014
Graziana Gatto, Daniel Morales, Artur Kania, Rüdiger Klein. EphA4 Receptor Shedding Regulates Spinal Motor Axon Guidance. Current Biology, 20. Oktober 2014. DOI: 10.1016/j.cub.2014.08.028

