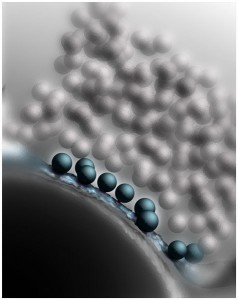
Dreidimensionale Rekonstruktion einer Synapse im Mausgehirn. Akut freisetzbare, fusionsfähige synaptische Vesikel (blau, etwa 45 Millionstel Millimeter Durchmesser) sind an der Zellmembran angedockt.
© MPI f. Experimentelle Medizin/Benjamin H. Cooper
Während Nervenzellen Informationen in ihrem Inneren schnell als elektrische Signale weiterleiten, kommunizieren sie untereinander an speziellen Kontaktstellen, den Synapsen. Dort werden chemische Botenstoffe, die Neurotransmitter, in sogenannten Vesikeln gespeichert. Wird eine Synapse aktiv, verschmelzen einige dieser Vesikel mit der Zellmembran und schütten ihren Inhalt aus. Damit bei diesem Prozess keine wertvolle Zeit verloren geht, halten Synapsen stets einige kurzfristig freisetzbare Vesikel bereit. Wissenschaftler konnten nun mit Hilfe hoch auflösender, dreidimensionaler Elektronenmikroskopie nachweisen, wie diese fusionsfähigen Vesikel auf ihren raschen Einsatz vorbereitet sind: Sie stehen bereits lange vor der eigentlichen Verschmelzung eng mit der Zellmembran in Kontakt. Darüber hinaus entschlüsselte das Forscherteam auch den molekularen Mechanismus, über den die Vesikel diesen Andockmechanismus vollziehen.
An der Verschmelzung der Neurotransmitter-Vesikel mit der Zellmembran sind viele Eiweißbausteine beteiligt. Sie arbeiten eng miteinander zusammen, um sich gegenseitig zu kontrollieren und zu gewährleisten, dass sich alle ‚Beteiligten‘ stets am richtigen Platz befinden. Die Wissenschaftler sprechen von einer Fusionsmaschinerie, und der Vergleich passt: Wenn ein Zahnrad eines Uhrwerk kaputt ist, bleiben die Zeiger stehen. In ähnlicher Weise stören defekte Moleküle oder ihr völliges Fehlen den Betriebsablauf an der Synapse.
Nils Brose und sein Kollege JeongSeop Rhee vom Max-Planck-Institut für Experimentelle Medizin in Göttingen konnten bereits vor Jahren zeigen, dass die Informationsweiterleitung an der Synapse in genetisch veränderten Mäusen stark beeinträchtigt ist. Bei den Tieren waren alle bekannten Gene der sogenannten Munc13- oder CAPS-Proteine ausgeschaltet worden. Fehlt Munc13, so kommt die Freisetzung der Neurotransmitter sogar vollständig zum Erliegen. Dabei unterscheiden sich die defekten Nervenzellen unter dem Lichtmikroskop in keiner Weise von denen gesunder Mäuse. Die Ergebnisse von Brose und Rhee zeigten, dass jede Synapse über eine kleine Menge ‚akut freisetzbarer‘, fusionsfähiger Vesikel verfügen muss, die es ihr erlaubt jederzeit und unmittelbar auf ein Signal reagieren zu können.
Doch wie überführen Munc13 und CAPS die Vesikel in einen solchen fusionsfähigen Zustand? Um diese Frage zu beantworten, nahmen die Göttinger Wissenschaftler die synaptischen Kontakte im wahrsten Sinne unter die Lupe. Die Neurobiologen Cordelia Imig und Ben Cooper, die bereits seit vielen Jahren mit Brose und Rhee zusammenarbeiten, verwendeten hierzu ein Hochdruck-Gefrierverfahren. Dabei werden Nervenzellen des Gehirngewebes blitzschnell und unter hohem Druck eingefroren, sodass sich keine störenden Eiskristalle bilden können und die Feinstruktur der Zellen besonders gut erhalten bleibt. Die so erhaltenen Proben wurden dann per Elektronentomographie analysiert. Bei dieser Methode werden, ähnlich wie bei der medizinischen Computertomographie, elektronenmikroskopische Aufnahmen aus vielen verschiedenen Winkeln von derselben Struktur aufgenommen. Die einzelnen Bilder können dann am Computer zu einer hoch aufgelösten, dreidimensionalen Abbildung einer Synapse zusammengesetzt werden (siehe Abbildung).
„Unsere Ergebnisse zeigten, dass akut freisetzbare Vesikel in gesunden Synapsen die Zellmembran berühren“, erklärt Cooper. „Fehlen jedoch Munc13 und CAPS Proteine, erreichen die Vesikel die aktive Zone nicht mehr und stauen sich wenige Nanometer davon entfernt an.“ Zu ihrer großen Überraschung beobachteten die Forscher weiterhin, dass auch sogenannte SNARE-Proteine, die mit Munc13 und CAPS in den Nervenenden zusammenarbeiten, an diesem Andockungsprozess beteiligt sind. SNARE-Proteine sitzen in gesunden Synapsen in Zell- und Vesikelmembranen und steuern das Verschmelzen der beiden Membranen während der Freisetzung der Neurotransmitter. Nähert sich ein Vesikel der Zellmembran, so legen sich die einzelnen SNARE-Moleküle, wie bei einem Reißverschluss, aneinander und ziehen so die Membranen eng zusammen. In diesem Zustand – quasi in den Startlöchern – warten die Vesikel auf den Startschuss für ihre Fusion.
Die Ergebnisse der Göttinger Neurobiologen belegen, dass Vesikel- und Zellmembran in der Synapse bereits vor dem Signal zum Verschmelzen durch das Zusammenspiel der Munc13-, CAPS- und SNARE-Proteine eng zusammengezogen werden. Nur so kann eine schnelle und kontrollierte Informationsweiterleitung an der Synapse gewährleistet werden, durch die wir rasch auf Informationen aus unserer Umwelt reagieren können. „Dass Synapsen extrem schnell sein müssen, um all die vielen komplexen Hirnfunktionen auszuführen, war schon lange klar. Unsere Studie zeigt zum ersten Mal, wie das auf Molekülebene und auf der Ebene der synaptischen Vesikel bewerkstelligt wird“, meint Brose. Da fast alle an diesem Prozess beteiligten Eiweißbausteine an neurologischen und psychiatrischen Erkrankungen beteiligt sind, gehen die Göttinger Wissenschaftler davon aus, dass ihre Entdeckung auch für die medizinische Forschung nutzbar sein wird.
Max-Planck-Gesellschaft, 23. Oktober 2014
Originalpublikation:
Imig, C., Min, S.-W., Krinner, S., Arancillo, M., Rosenmund, C., Südhof, T.C., Rhee, J.-S., Brose, N. and Cooper, B.H. The morphological and molecular nature of synaptic vesicle priming at presynaptic active zones. Neuron 84, 416-431 (23. Oktober 2014). DOI: 10.1016/j.neuron.2014.10.009

