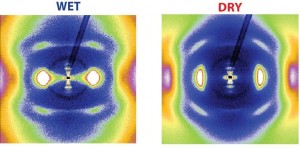
Röntgenblick auf Kollagen: Aus den Mustern der zweidimensionalen Röntgenbeugung lassen sich Informationen über Änderungen in der molekularen und nanoskopischen Kollagenstruktur gewinnen, wenn das Protein trocknet. Die Struktur des Kollagens ist für die Krafterzeugung ausschlaggebend.
© Nature Communications 2015 / MPI für Kolloid- und Grenzflächenforschung
Unser Körper verdankt seine Festigkeit vor allem einem faserbildenden Protein: dem Kollagen. Stabilisierende Strukturen wie Knochen, Sehnen, Bänder oder die Haut enthalten es in großen Mengen. Wie Wissenschaftler nun bei einer eingehenden Untersuchung von Kollagen herausfanden stellt Wasser, ein Stoff, den wir kaum mit Festigkeit assoziieren, einen integralen Bestandteil des Kollagens dar. Als das Forscherteam das Wasser aus den Kollagenfasern entfernte, wirkte sich dies dramatisch aus. Die Fasern zogen sich zusammen und erreichten dadurch eine 300-Mal stärkere Spannung, als Muskeln sie auszuüben vermögen. Dieses Wissen könnte für neuartige, aktive Materialien genutzt werden. Die Ergebnisse deuten aber auch darauf hin, dass Kollagen in Lebewesen mehr Funktionen erfüllen kann, als bisher angenommen. Demnach spielt es nicht nur eine passive Rolle als eine Art Stützapparat für den Organismus. Es kann auch eine aktive Rolle spielen: etwa bei der Bildung von Knochen.
Tripelhelix von Kollagen. © Nevit Dilmen. CC BY-SA 3.0.
Kollagenfasern sind aus einer komplexen Anordnung von Einzelteilen aufgebaut. Den Grundbaustein stellt dabei ein einzelnes Kollagenmolekül dar. Es ähnelt in seiner Struktur einem Seil: Jeweils drei dieser kettenförmigen Proteine sind zu einer Dreifachhelix umeinander gewunden. Viele dieser verdrillten „Seile“ wiederum verbinden sich zu dickeren „Tauen“, so genannten Kollagenfibrillen. Mit rund 100–500 Nanometern Dicke sind die Fibrillen allerdings 100 000 Mal dünner als wirkliche Taue. In den Fibrillen liegen die benachbarte Kollagenmoleküle versetzt aneinander, sodass eine gestaffelte Anordnung entsteht. Das führt entlang der Fibrille zu einer wechselnden Dichte. Viele Fibrillen zusammen bündeln sich zu Kollagenfasern.

Elektronenmikroskopische Aufnahme von Kollagenfasern. © public domain.
Wissenschaftler des Max-Planck-Instituts für Kolloid- und Grenzflächenflächenforschung in Potsdam-Golm haben nun die mechanischen Eigenschaften von Kollagen und vor allem die funktionelle Bedeutung des darin enthaltenen Wassers untersucht. Das Besondere an der Studie: Die Forscher kombinierten erstmals verschiedene Messmethoden, um Kollagen auf den verschiedenen Ebenen seines Aufbaus zu untersuchen. Dazu kontrollierten sie in einer Feuchtigkeitskammer den Wassergehalt der Naturfaser. Mit Hilfe einer speziellen Vorrichtung in der Kammer konnte das Team die auf das Kollagen wirkenden Zugkräfte messen.
Wasser ist ein integraler Bestandteil des Kollagens
Das Forscherteam kombinierte ihre experimentellen Ergebnisse mit Computersimulationen von Kollagenmolekülen. So kam es der Bedeutung des Wassers in den Kollagenmolekülen auf die Spur.
„Wasser ist ein integraler Bestandteil von Kollagen“, sagt Admir Masic. Im natürlichen Zustand macht es rund 60 Prozent des Kollagens aus. Wassermoleküle fügten sich so nahtlos in das Kollagen ein, dass sie dessen Helixform folgen, berichtet Masic. Das fand das Team durch Untersuchungen mit Röntgenbeugung heraus. Mit dieser Methode lassen sich Details der Helixstruktur erforschen, wie etwa die Neigung der Windungen oder der Durchmesser der Helix.
Bei dem hohen Wassergehalt verwundert es nicht, dass sich der Entzug von Wasser dramatisch auswirkt. Nimmt die relative Luftfeuchtigkeit von 95 auf 5 Prozent ab, trocknet man das Kollagen also praktisch aus, so ziehen sich die Kollagenmoleküle um 1,3 Prozent und die entsprechenden Fibrillen sogar um 2,5 Prozent zusammen. Trotz dieser relativ geringen Längenänderung entsteht dabei ein Zug von 100 Megapascal. Das ist die 300-fache Zugkraft eines Muskels.
Kollagen unter Wasserentzug: Dichte Regionen der Fibrillen dehnen sich, dünne ziehen sich zusammen
Auch dem Mechanismus der durch den Wasserentzug hervorgerufenen Kontraktion kamen die Forscher auf die Spur. Mit der Raman-Spektroskopie bestimmten sie die Konformation der Molekülketten des Kollagens. Die Konformation ist die räumliche Anordnung der drehbaren Bindungen an den Kohlenstoffatomen. Wie sich zeigte wird die Verkürzung durch ein Umklappen der Molekülketten hervorgerufen. Ähnlich wie bei einem zunächst gestreckten Seil, das in Wellen geworfen wird rücken nach der Konformationsänderung die Enden näher zusammen. Dabei drehen sich die dichten Bereiche der Fibrillen um ihre eigene Achse, während sich die dünneren zusammenziehen. Das führt insgesamt zu einer Kontraktion der Fibrillen.
„Mit diesem Wissen könnten Materialien entwickelt werden, die sich bei Entzug von Wasser gegensätzlich verhalten“, sagt Luca Bertinetti. Er denkt dabei zum Beispiel an aufeinander geklebte Schichten von zwei Materialien, von denen sich die eine bei Wasserentzug ausdehnt und die andere zusammenzieht. Das würde eine Biegung der Doppelschicht zur Folge haben. Wie die Messergebnisse des Teams zeigen, könnten solche Werkstoffe große Kräfte ausüben. Auch für die Produktion von Leder oder Pergamentpapier könnten die neuen Erkenntnisse hilfreich sein.
Potenzielle, noch unerforschte aktive Funktion von Kollagenfibrillen
Doch nicht nur für die Technik sind die Ergebnisse interessant. Zwar kommt ein so starker Wasserentzug wie in der Feuchtigkeitskammer unter physiologischen Bedingungen im Körper eines Lebewesens wahrscheinlich nicht vor. Aber immerhin kann auch unter physiologischen Bedingungen ein so hoher Wasserentzug vorkommen, dass das Kollagen dabei zumindest eine der Muskelkraft entsprechende Zugspannung aufbauen kann.
Daher könnte dem Biomolekül, über seine passive Rolle der mechanischen Stabilisierung des Körpers hinaus, noch eine aktivere Rolle zukommen „Während des Aufbaus von Knochen könnte dem darin enthaltenen Kollagen Wasser entzogen werden, so dass es sich zusammenzieht“, sagt Peter Fratzl, der diese Forschungsarbeit koordiniert hat. Dadurch werde der Knochen zusammengehalten, wodurch verhindert werde, dass das von Natur aus spröde Material durch Zugspannungen auseinandergerissen werde. Dann hätte Kollagen eine ähnliche Rolle, wie der Stahl im Stahlbeton, vergleicht Fratzl.
Die Wissenschaftler begründen ihre Annahmen damit, dass der Abstand zwischen den dichten Zonen der Kollagenfibrillen im Knochen der gleiche ist wie in getrocknetem Kollagen und dass die Zugfestigkeit von Knochen in etwa der Zugkraft von getrocknetem Kollagen entspricht.
Als nächstes wollen die Forscher die physiologische Rolle der Kollagenkontraktion in verschiedenen Geweben erforschen.
Max-Planck-Gesellschaft, 22. Januar 2015
Originalpublikation:
Admir Masic, Luca Bertinetti, Roman Schuetz, Shu-Wei Chang, Hartmut Metzger, Markus J. Buehler & Peter Fratzl. Osmotic pressure induced tensile forces in tendon collagen. Nature Communications; 22 January 2015; DOI: 10.1038/ncomms6942

