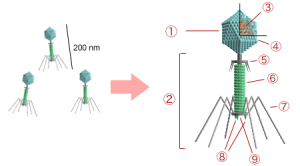
Struktur eines T-Phagen: 1. Kopf, 2. Schwanz, dient als Einspritzapparat, 3. Nukleinsäure, 4. Kapsid, 5.Hals, 6. Schwanzrohr, 7. Schwanzfibern und 8. Spikes, mit denen die Wirtszelle erkannt wird. 9. Grundplatte. © Y tambe. CC BY-SA 3.0.
Die Zahlen sind alarmierend. Jedes Jahr sterben in Deutschland c.a. 40.000 Menschen an Infektionen mit multiresistenten Bakterien. Tendenz steigend. Abhilfe könnten natürliche Feinde der Bakterien leisten: die Bakteriophagen. Sie zeichnen sich nicht nur durch eine hohe Spezifität gegenüber ihrem Wirt aus, sondern sind außerdem in der Natur im Überfluss vorhanden. Mediziner in Osteuropa haben mit ihrem Einsatz jahrzehntelang gute Erfahrungen gemacht. Angesichts der bedrohlichen Zunahmen von Antibiotikaresistenzen unter krankheitserregenden Bakterien sollten wir dieses natürliche Reservoir an Bakteriophagen nicht ungenutzt lassen.
Die Problematik multiresistenter Keime
Bakterien sind einzellige Organismen ohne Zellkern. Die meisten aller auf der Erde vorkommenden Bakterien sind harmlos, schaden dem Menschen also nicht. Einige von ihnen sind nützlich und leisten uns in der Lebensmittelherstellung, im Bergbau und in der Wasseraufbereitung gute Dienste. Andere Keime sind für uns sogar lebenswichtig, wie unsere Darmflora oder die Bakterien, die unsere Haut besiedeln und so dafür sorgen, dass dort schädliche Keime keine Chance haben. Nur etwa 10% aller Bakterien sind für uns potentiell gefährlich.
Lange Zeit glaubte man mit der Entwicklung der Antibiotika den Kampf gegen die bakteriellen Krankheitserreger gewonnen zu haben. Doch durch einen übermäßigen Einsatz von Antibiotika in der Medizin und vor allem in der Tierzucht, hat die Zahl der Bakterienarten mit multiplen Antibiotikaresistenzen in den letzten Jahrzehnten drastisch zugenommen. Um in dieser von Antibiotika durchsetzten Umwelt zu überleben, blieb den Bakterien gar nichts anderes übrig, als möglichst viele Resistenzmechanismen gegen Antibiotika zu erwerben und in ihr Erbgut einzufügen. Diese Resistenzgene geben sie nun an ihre Nachkommen weiter, so dass auch diese in einer Umwelt mit vielen Antibiotika überleben können.
Da Bakterien über Artgrenzen hinweg Gene austauschen können, haben sich diese Resistenzen inzwischen auch auf im Wasser und im Boden lebe Keime übertragen. Derweil haben selbst solche Keime Resistenzen gegen Antibiotika erworben, die nicht in direktem Kontakt mit dem Menschen stehen. Dazu ist es unter anderem deswegen gekommen, weil sich Bakterien auf der Erde schnell weiträumig verbreiten. Viele verschiedene Faktoren, wie Wasser, Wind und Tiere, sowie mit zunehmender Mobilität und Globalisierung auch der Menschen unterstützen sie in ihrer Verbreitung. So hat sich das Erbgut von Multiresistenzen und teilweise sogar von Totalresistenzen gegen alle gängigen Antibiotika mittlerweile auf der ganzen Erde ausgebreitet. Heute findet man selbst in entlegenen Gegenden und im Erdboden multiresistente Bakterien.
Besonders gefährlich werden diese multiresistenten Keime im Krankenhaus. Denn dort treffen beim Menschen weit verbreitet Keime, die in oder auf ihm leben auf Patienten mit einer geschwächten Immunabwehr. In diesem Szenario entfalten sich diese eigentlich harmlosen Bakterien, die für Gesunde völlig unproblematisch sind, plötzlich zu einer massiven Gefahr, die mit gängigen Antibiotika immer öfter nicht mehr in den Griff zu bekommen ist.
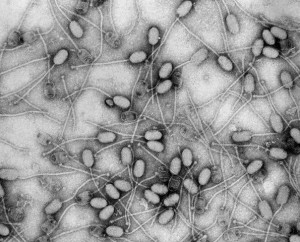
Phagen von Staphylococcus aureus. © Bacter. CC BY-SA 3.0.
Typische Keime dieser Art sind Pseudomonas aeruginosa oder Staphylococcus aureus. Wenn es dem Immunsystem von geschwächten Patienten nicht mehr gelingt, die Keime selbst in Schach zu halten, müssen Antibiotika zu ihrer Bekämpfung eingesetzt werden. Für die Patienten, die dringend so schnell wie möglich gesunden sollten ist es dann fatal, wenn diese einst so zuverlässigen Waffen im Kampf gegen die Keime versagen und sie gerade in dieser Situation Opfer eines häufig vorkommenden Keimes werden, den jeder Gesunde in sich trägt. Diese Entwicklung lässt sich nicht rückgängig machen. Gegen sie hilft nur extreme Hygiene und möglichst steriles Arbeiten. Das ist aber im Umgang von Menschen miteinander sehr schwierig bis unmöglich umzusetzen.

Bacillus Anthracis Lysehof durch Gamma-Phagen
rechts unbefallene Einzelkolonie.
© public domain.
Bakteriophagen, die Bakterienfresser
Bereits 1915 entdeckte der britische Bakteriologe Frederick W. Twort ein Agens, das Bakterien infiziert und abtötet. Er beschäftigte sich aber nicht weiter mit diesem Phänomen. Unabhängig davon entdeckte der Frankokanadier Felix Hubert D’Herelle 1917 in Bakterienkulturen klare Stellen, sogenannte Plaques. Die Proben stammten von Patienten, die sich von ihrem schweren, durch das Ruhrbakterium verursachten Durchfall wieder erholt hatten. Bei dieser Genesung musste ihnen der unsichtbare Verursacher der Plaques geholfen haben. D’Herelle hatte nichts weniger als einen Mikroorganismus entdeckt, der den Ruhrbazillus (Shigella dysenteriae) vernichten konnte. In seinen Erinnerungen schrieb D’Herelle voller Begeisterung über seine Entdeckung: „Es war einer dieser seltenen Momente intensiver allumfassender Glücksgefühle, die einem Forscher höchstens zwei- oder dreimal in seinem Leben zuteil werden, und die ihn für all die schlaflosen Nächte und all die Jahre der Arbeit vollends entschädigen.“
D’Herelle hatte sich als Autodidakt mit Gärungsprozessen beschäftigt. In Mexiko war es ihm gelungen eine Heuschreckenplage zu bekämpfen, indem er ein für die Heuschrecken schädliches Bakterium namens Coccobacillus aus deren Darm isolierte, es vermehrte und wieder gegen die Heuschrecken einsetzte. 1911 war er als Assistent an das berühmte Pariser Institute Pasteur gelangt.
Nach seiner Beschreibung der Plaques in Bakterienrasen 1917 wurde in der Fachwelt lange und kontrovers darüber diskutiert, worum es sich bei seiner Entdeckung wohl handelte. Denn damals waren die Grundlagen dieses Phänomens noch unbekannt. D’Herelle gab den unsichtbaren Bakterien vernichtenden Organismen den Namen Bakteriophagen. Der Name leitet sich vom griechischen Wort phagein für fressen ab. Bakteriophagen sind also Bakterienfresser. Nach seiner Entdeckung sollte D’Herelle sein gesamtes weiteres Leben der Erforschung der Bakteriophagen und deren Einsatz zur Behandlung bakterieller Infektionen widmen. In den 1920er Jahren gründete er in Tiflis, der Hauptstadt von Georgien, zusammen mit seinem Assistenten, dem georgischen Bakteriologen Georgi Eliava ein Instutut für Phagenforschung. Dort optimierten sie die Phagentherapie zur Bekämpfung einiger weit verbreiteter Infektionskrankheiten. Die Heilungserfolge waren für die damalige Zeit beeindruckend und so kam die Phagentherapie regelrecht in Mode. Damals wurden bakterielle Infektionen auch in Europa und den USA erfolgreich mit Phagen behandelt. Selbst Pharmafirmen wie Eli Lilly und die Behringwerke arbeiteten auf diesem Gebiet. Das Wirkprinzip dieser Therapie war aber nach wie vor noch unbekannt.
Mit dem Siegeszug der Antibiotika in den 1940er Jahren geriet die therapeutische Anwendung der Phagen bei uns in Vergessenheit. Die Phagen selbst wurden dagegen zu einem beliebten Werkzeug in der Wissenschaft. Forscher, wie Max Delbrück, Salvador Luria, Alfred Hershey und Martha Chase begründeten durch ihre Arbeit an Bakteriophagen das Fachgebiet der Molekularbiologie. In diesem Zusammenhang wurde unter anderem auch geklärt, ob Nukleinsäuren oder Proteine die Träger der Erbinformation sind. Phagen erfreuen sich in der Molekularbiologie, Gentechnik und Biotechnologie auch heute noch großer Beliebtheit. Im Verlaufe dieser Forschungsarbeiten hat man eine Menge über Phagen gelernt: Heute weiß man, dass Phagen Viren sind, die Bakterien infizieren. Dabei sind sie hoch spezifisch, denn sie befallen nur ganz bestimmte Stämme einer Bakterienart. Für andere Organismen sind sie völlig harmlos. Phagen sind so weit verbreitet wie kein anderer Organismus auf der Welt. Ihre Zahl wird auf 10 E31 geschätzt. Das Zehnfache der Bakterienwelt. Tatsächlich nehmen wir mit jedem Bissen und jedem Schluck Wasser Unmengen an Phagen auf. Wir leben in einer Welt von Phagen, ohne es überhaupt wahrzunehmen. Der Grund dafür ist einfach: Phagen können sich nicht alleine Vermehren. Wie andere Viren brauchen sie dazu einen Wirt. In dem Fall der Phagen sind das die Bakterien. Da sie so klein und für uns harmlos sind, merken wir nichts von ihrer Anwesenheit.
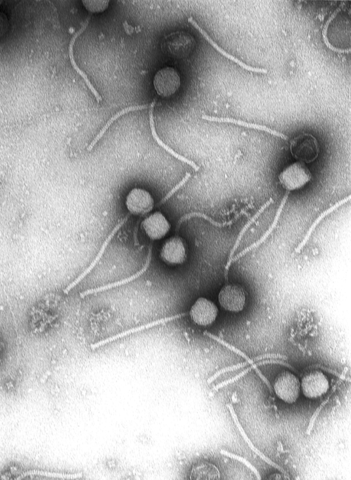
Gamma Phage, der Bacillus anthracis lysieren kann, unter dem Elektronenmikrokop © Vincent Fischetti & Raymond Schuch. CC BY 2.5
Wie sind Phagen aufgebaut und wie wirken sie?
Phagen sind sehr viel kleiner als Bakterien. Sie sehen aus wie eine Mondlandefähre und bestehen aus einem Kopf und einem Schwanz. Der polyedrische Kopf wird durch Proteine gebildet, die so dicht gepackt sind, wie in einem Kristall. In seinem Inneren wartet die Erbinformation des Phagen in Form von Nukleinsäure, meist DNA, auf ihren Einsatz. Der Kopf ist nur unter dem Elektronenmikroskop sichtbar. Deshalb konnten die Wissenschaftler zu D’Herelles Zeiten über die Wirkungsweise der Phagen nur spekulieren, denn ihnen fehlten schlichtweg die technischen Möglichkeiten, um die Frage abschließend zu klären.
Der Schwanz des Phagen besteht ebenfalls aus Proteinen und trägt an seinem Ende eine Erkennungsstruktur, den sogenannten Rezeptor. Dieser verleiht dem Phagen seine hohe Spezifität, denn mit ihm erkennt er die Zelloberfläche seines Wirtsbakteriums. Jeder Phage erkennt nur solche Bakterien, die an ihrer Oberfläche genau die Struktur besitzen, an die sein Rezeptor binden kann. Bakterien, denen diese Struktur fehlt erkennt er nicht.
Wenn ein Phage das passende Wirtsbakterium gefunden hat heftet er sich an dessen Oberfläche an, schießt sein Erbgut aus dem Kopf in das Bakterium hinein und zwingt es so, die auf seinem Erbgut kodierten Proteine zur Bildung neuer Phagen zu produzieren. Die Proteinsynthesemaschinerie des Bakteriums wird dazu gezwungen so viele neue Phagen zu bilden, bis sie platzt und die neuen Phagen auf diese Weise freigesetzt werden. Sie erkennen dann über ihren Rezeptor sofort wieder neue, passende Bakterienzellen und infizieren sie. Dieser Prozess wiederholt sich so lange, bis alle Bakterien abgetötet sind. Im Labor kann man diesen, Lyse genannten, Prozess durch das Entstehen von Löchern im dicht gewachsenen Bakterienrasen erkennen.
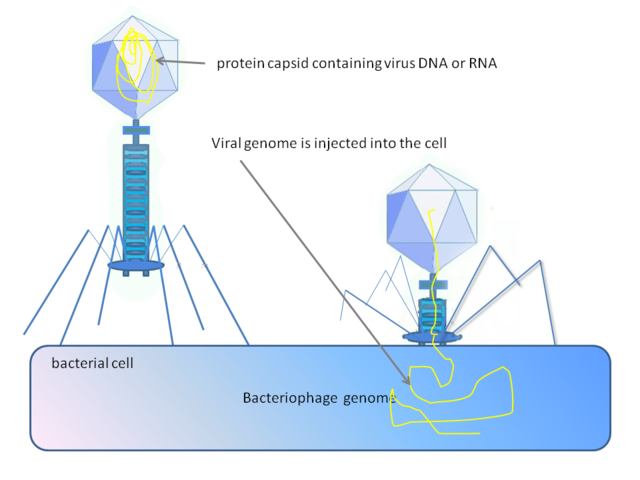
Ein Bakteriophage injiziert sein Genom in ein Bakterium © Graham Colm. CC BY-SA 3.0
Die große Zahl der Phagen „frisst“ die Bakterien so lange weg, wie Bakterien vorhanden sind, deren Oberfläche sie mit ihrem Rezeptor erkennen. Bei einer großen Bakterienpopulation wird es immer auch einzelne Keime geben, die aufgrund von Mutationen an ihrer Oberflächenstruktur von den Phagen nicht mehr erkannt werden können und deshalb resistent gegen sie werden. Da die Zahl der Phagen aber ebenfalls sehr groß ist kommen auch bei den Phagen Mutationen vor, die ihrerseits dazu führen können, das die Phagen die mutierten Bakterien wieder erkennen und sie wieder lysieren können. In einer natürlichen Umgebung stellt sich auf diese Weise ein Gleichgewicht zwischen den Bakterien und den Bakteriophagen ein.
Neben den lytischen Phagen, die nach der Infektion einer Bakterienzelle sofort zur Bildung neuer Phagen schreiten gibt es auch nicht-lytische Phagen. Sie integrieren ihr Genom in das Erbgut ihres Wirtsbakteriums und warten mit der Lyse bis es dem Bakterium schlecht geht. Diese Phagen eignen sich nicht für eine Therapie.
Bakteriophagen als Therapeutikum
Da Osteuropa während der Zeit des Kalten Krieges keinen Zugang zu Antibiotika hatte wurde die Phagentherapie dort über viele Jahre erfolgreich eingesetzt. Phagen können überall dort eingesetzt werden, wo Bakterien der menschlichen Gesundheit schaden. Lytische Phagen für eine Therapie werden entweder neu aus einem natürliche Standort gesucht, indem man ihre Wirksamkeit gegen das gewünschte Zielbakterium in einer Testreihe überprüft. Dieser Vorgang wird Screening genannt. Dabei sind Phagen überall dort zu finden, wo auch die jeweiligen Bakterien vorkommen. Schon D’Hérelle konnte 1920 während eines Besuches in Indochina aus mit der Pest infizierten Ratten Bakteriophagen isolieren, mit deren Hilfe er pestkranke Menschen behandeln konnte. Und bei Forschungsarbeiten über die Cholera in Indien isolierte er Bakteriophagen aus genesenen Cholerapatienten. Zur Bekämpfung der Cholera in den Dörfern tropfte seine Arbeitsgruppe Bakteriophagenlösungen in deren Ziehbrunnen. Mit Hilfe dieser Behandlung konnte er nach eigenen Angaben die Todesrate von 60% auf 8% senken. Bei weiter verbreiteten Krankheiten kann man aber oft auch auf den bestehenden Fundus von gut charakterisierten Phagen zurückgreifen, die man dann direkt einsetzen kann. Zur Sicherheit wendet man dabei oft einen sogenannten „Phagencocktail“ an. Das ist eine Mischung aus verschiedenen Phagen. D’Hérelle hatte seinerzeit bereits Phagencocktails angewandt, um Resistenzen von Bakterien gegen Bakteriophagen zu überwinden.
Die umfangreichen Kenntnisse in der Phagenbiologie und die jahrzehntelangen Erfahrungen mit der erfolgreichen Phagentherapie in Osteuropa und Russland sprechen für eine nebenwirkungsfreie Anwendung von Phagen in der Therapie. Das für die Phagen typische, restlose Auflösen der Bakterien trägt zudem zu einer guten Wundheilung bei. Da Phagen in der Natur im Überfluss vorhanden sind, stellen sich entwickelnde Bakterienresistenzen gegenüber den für die Therapie eingesetzten Phagen keine wirkliche Bedrohung dar. Sobald ein Bakterium gegen einen Phagen resistent geworden ist, kann man durch ein erneutes Screening jederzeit wieder einen passenden Phagen aus der Umwelt isolieren. Da Phagen Strukturen auf der Zelloberfläche der Bakterien erkennen ist es für die Phagentherapie zudem unerheblich, ob das Bakterium gegen bestimmte Antibiotika resistent ist. Allerdings muss vor einer Phagentherapie der krankheitsverursachende Keim genau bestimmt werden, um den richtigen Phagen für die Therapie auswählen zu können.
Mögliche Einsatzgebiete einer Phagentherapie sind unter anderem Eiterwunden, Abszesse, chronische Entzündungsprozesse, ein hartnäckiger Bakterienfilm der oberen Atemwege und Brandwunden. In all diesen Fälle kommt es zu einem ausufernden Bakterienwachstum, das das menschliche Immunsystem nicht mehr abwehren kann. Bisher helfen dann nur noch Antibiotika gegen die ungebremste Vermehrung der Bakterien.
Die meisten Antibiotika haben ein breites Wirkspektrum, so dass bei einer Antibiotikatherapie meist nicht nur die krankheitsverursachende (pathogene) Bakterienart abgetötet wird, sondern gleichzeitig auch für uns nützliche Keime, wie unsere Darmbakterien massenhaft absterben. Das kann nach einer Therapie gravierende Konsequenzen haben, weil es dann zu einer Besiedelung der in unserem Körper frei gewordenen „ökologischen Nische“ durch pathogene Bakterien kommen kann. Dagegen ist die Wirkung der Phagen viel spezifischer. So präzise wie das Schlüssel-Schloss-Prinzip erkennen sie über den Rezeptor an ihrem Schwanz fast immer nur eine Bakterienart und manchmal auch nur wenige Stämme innerhalb einer Bakterienart. Deshalb sind Phagen eine gute Alternative zu Antibiotika, denn ein für ein pathogenes Bakterium spezifischer Phage kann dieses schnell, spezifisch und ohne bekannte Nebenwirkungen abtöten. Die für uns so wichtige Darmflora lässt er dabei intakt.
Sobald der Phage sein Zielbakterium vernichtet hat hört seine Vermehrung aufgrund des Mangels an neuen Wirtsorganismen auf und er zerfällt in seine Bestandteile, die der Mensch problemlos abbauen kann. Antibiotika können Bakterien nur während ihres Wachstums bekämpfen, Bakteriophagen dagegen können ihr Zielbakterium unabhängig von deren Wachstum lysieren. Das kann ein Vorteil bei der Bekämpfung von bestimmten Bakterien sein, die im menschlichen Körper ruhen und mit ihrem Wachstum warten, bis der Mensch geschwächt ist. Solche Keime könnte man mit einem Antibiotikum nicht bekämpfen, wohl aber mit einem Phagen. Da Phagen, wie bereits erwähnt, zu den am weitesten verbreiteten Organismen der Erde gehören, ist das menschliche Immunsystem mit den Phagen vertraut und entwickelt keine Allergien gegen sie.
Rechtslage zur Phagentherapie in Europa
Zur Zeit fehlt in Europa ein regulatorischer Rahmen für die Anwendung von Phagen in der Klinik. In der über zehn Jahre alten EU Direktive 2001/83/EG über medizinische Produkte für die Anwendung am Menschen werden Phagen nicht genannt. Deshalb ist Phagentherapie auch nicht illegal. Sie wird nur in dem bestehenden Regelwerk nicht explizit erwähnt. Würden Phagen in die Direktive aufgenommen, so müssten für ihre Zulassung klinische Studien durchgeführt werden. Die Stärke der Phagentherapie liegt jedoch gerade in ihrer Individualität und dem schnellen Verfügbar machen eines spezifischen Phagen. In diesem Kontext wären klinische Studien für jeden einzelnen Phagen sinnlos. Das ist einer der Gründe, warum bisher in Europa kaum Geld in die Phagentherapie investiert wird. Zur Zeit wird eine kleine Zahl von Studien in Westeuropa durchgeführt, um die Sicherheit und Wirksamkeit von Phagentherapien deutlich zu machen. In einer ersten Studie, die heutigen Standards entspricht, wurde 2009 über ein Phagenpräparat gegen Pseudomonas aeruginosa berichtet. Dieser Keim ist für seine Beteiligung an schwer behandelbaren Entzündungen und seine multiplen Antibiotikaresistenzen berüchtigt. Die an der Studie teilnehmenden Patienten litten seit Jahrzehnten an einer schweren Mittelohrentzündung. Bereist sechs Tage nachdem die Patienten das Phagenpräparat erhalten hatten verbesserte sich der Gesundheitszustand von 92% der Patienten deutlich. Ein viertel der Patienten konnte sogar geheilt werden. Eine weitere Studie, an der eine größere Zahl von Patienten teilnehmen soll, ist bereits in Gang. Um die Wirksamkeit von Phagentherapien abzuklären, sollten möglichst viele Doppelbild Studien mit einer Großen Patientenzahl durchgeführt werden. Erst dann wird sich erweisen können, wie effektiv diese Art der Therapie wirklich ist.
Phagentherapie in Deutschland
In Deutschland wendet Prof. Dr. Burkhard Wippermann, Chefarzt an der Chirurgischen Klinik II des Klinikums Hildesheim (private Helios Klinik) Phagen als individuellen Heilversuch an. Er setzt diese Methode bei Patienten mit schlecht heilenden, offen zugänglichen Wunden an, die mit multiresistenten Erregern infiziert sind. Die Phagen werden in einer Lösung auf die Wunde gegeben, die im Idealfall nach c.a. einer Woche verheilt. Allerdings funktioniert die Methode nicht immer. Warum, das der Fall ist, ist noch nicht geklärt. Dafür hat Wippermann aber auch noch keine Nebenwirkungen beobachtet. Die Fallzahl der von Wippermann behandelten Patienten ist aber auch noch sehr gering, so dass man seine Erfahrungen nicht gut verallgemeinern kann: In eineinhalb Jahren hat er vier solcher Fälle behandelt, von denen zwei erfolgreich waren. Die Kosten für diese Behandlung müssen die Patienten selbst übernehmen. Sie liegen zwischen 1000.- und 3000 .- Euro für die Phagen. Die Behandlungskosten selbst werden meist von der Krankenkasse getragen.
Wenn sich ein Patient zusammen mit dem behandelnden Arzt für eine Phagentherapie entschieden hat dürfen nur gereinigte, genau charakterisierte und strikt lytische Phagen eingesetzt werden. Für diese umfassende Charakterisierung der Phagen stehen Vergleichsdaten und modernste Labormethoden zur Verfügung. Wenn die Entscheidung für die Phagentherapie gefallen ist plant der behandelnde Arzt zusammen mit dem Patienten den Therapieplan.
Das NDR berichtete in einem Video mit dem Titel „Mit Phagen gegen multiresistente Keime“ von dem Fall einer Frau, die über Jahre an einer offenen Wunde gelitten haben soll. Die Infektion wäre bereits auf den Knochen übergegangen und die Ärzte hätten keine andere Möglichkeit mehr gesehen, als ihr Bein zu amputieren. Verzweifelt habe sie im Internet nach einer Alternative gesucht und wäre dabei auf die Phagentherapie gestoßen. Nachdem Prof. Dr. Burkhard Wippermann sie mit geeigneten Phagen therapiert hatte, soll die offene Wunde endlich abgeheilt sein (siehe Link zum Video weiter unten).
Von Ute Keck
Weiterführende Literatur:
M. Schenk. Bakteriophagen: Eine Alternative zu Antibiotika? Dtsch med Wochenschr 2014; 139(04): 124-125 DOI: 10.1055/s-0033-1353962
Leibniz-Institut DSMZ – Deutsche Sammlung von Mikroorganismen und Zellkulturen in Braunschweig.
http://www.ndr.de/ratgeber/gesundheit/Mit-Viren-gegen-multiresistente-Bakterien,phagen101.html
Bakteriophagen und Phagentherapie: Fragen und Antworten im Überblick.
Georg Eliava Institute of Bakteriophages, Microbiology and Virology.

