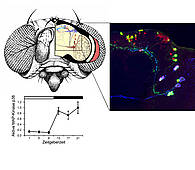
Die MAP-Kinase p38 wird in den Uhren-Neuronen im Gehirn der Taufliege exprimiert und ist nachts aktiv (links unten). Sie interagiert mit dem Uhren-Protein Period und verbindet auf diese Weise das Stress-System mit der inneren Uhr. Rechts oben ist das neuronale Netzwerk der inneren Uhr zu sehen, angefärbt mit Antikörpern gegen verschiedene Neuropeptide. © AG Förster. Universität Würzburg.
Das Leben aller Organismen wird von zwei entgegengesetzten Polen bestimmt: dem sich gleichförmig wiederholenden Tag-Nacht-Rhythmus und der Unterbrechung dieser Gleichförmigkeit durch plötzlich auftretende Ereignisse. Um diese unterschiedlichen Anforderungen gleichermaßen meistern zu können haben Lebewesen erfolgreiche Strategien entwickelt, die überraschende Gemeinsamkeiten aufweisen.
Zwei entgegengesetzte Phänomene bestimmen das Leben aller Organismen: Der sich ständig wiederholende 24-Stunden-Rhythmus von Tag und Nacht und das nicht vorhersehbare Auftreten plötzlicher Ereignisse. Auf beide muss jedes Lebewesen ganz unterschiedlich reagieren. So haben sich denn auch im Laufe der Evolution verschiedene Reaktionsmuster entwickelt, um auf diese beiden Phänomene angemessen zu antworten: Sogenannte Innere Uhren passen den Organismus an die sich regelmäßig wiederholenden Anforderungen das Alltags an. Sobald jedoch ein unvorhersehbares Ereignis eine schnelle Reaktion erfordert kommt das Stress-System zum Einsatz.
Hohe Stressbelastung kann den Tag-Nacht-Rhythmus durcheinander bringen
Aber die beiden Systeme wirken nur auf den ersten Blick völlig verschieden. Denn, wie jüngste Forschungsergebnisse zeigen, besitzen diese beiden Systeme auch Gemeinsamkeiten, die sie voneinander abhängig machen. Viele von uns kennen dieses Phänomen aus eigener Erfahrung: In Abhängigkeit von der Tageszeit reagieren wir ganz unterschiedlich auf Stress. Und damit nicht genug: massiver Stress kann unseren Tag-Nacht-Rhythmus durcheinander bringen und unsern Schlaf stören.
Bisher kannte man die molekularen und zellulären Grundlagen dieser Gemeinsamkeiten noch nicht im Detail. Nun konnten Wissenschaftlern der Universität Würzburg ein Element identifizieren das die beiden Systeme miteinander verbindet. Die Chronobiologin Charlotte Helfrich-Förster und ihr Team konnten nachweisen, dass das Enzym Mitogen-aktivierte Proteinkinase p38 in den Signalwegen beider Systeme eine wichtige Rolle spielt.
„Schon seit Längerem ist bekannt, dass p38 eine wichtige Komponente der Immun- und Stress-Signalwege ist. Wir konnten jetzt erstmals zeigen, dass das Enzym außerdem Bestandteil der zentralen inneren Uhr ist und dort wichtige Funktionen übernimmt“, erklärt Charlotte Helfrich-Förster das Ergebnis ihrer Studie.
Die Forscher haben am Beispiel der Taufliege Drosophila melanogaster die Rolle von p38 untersucht. Das Insekt ist ein beliebter Modellorganismus, da viele seiner Gehirn- und Nervenfunktionen denen des Menschen ähneln. Zwar ist die Zahl der Nervenzellen der Taufliege mit nur rund 80.000 deutlich niedriger als beim Menschen, dessen Gehirn aus ungefähr 100 Milliarden dieser Zellen besteht. Aber die grundlegenden Prinzipien sind in diesem einfachen Organismus in gleicher Weise ausgeprägt, der sich vergleichsweise einfach genetisch manipulieren lässt. Dort können die Forscher zum Beispiel gezielt einzelne Proteine ausschalten und danach untersuchen, welche Wirkung dies auf den Gesamtorganismus hat.
Kommt p38 in der innere Uhr von Drosophila vor?
In einem ersten Schritt untersuchten die Wissenschaftler, ob das Enzym im System der inneren Uhren von Drosophila vorkommt. Das System besteht aus ungefähr 150 „Uhren-Neuronen“ im Gehirn der Fliege, die sich aus neun Untergruppen zusammensetzen. Wie sich zeigte ist p38 zwar nicht in allen, aber doch in einigen dieser Nervenzellen aktiv.
Im nächsten Schritt schalteten die Forscher p38 ab oder überexprimierten es – erhöhten also seine Konzentration über die normalerweise vorhandene Menge – und untersuchten, wie sich danach das Verhalten der Fliegen veränderte.
Welche Auswirkung hat das Enzym auf die innere Uhr?
„p38 ist in den Zellen der Taufliege besonders aktiv, wenn es dunkel ist. Im Hellen ist es inaktiv“, sagt Charlotte Helfrich-Förster. Dieses Ergebnis war für die Forscher völlig überraschend. Zwar werden die Gene für die Bildung des Enzyms den ganzen Tag abgelesen und das entsprechende Protein synthetisiert. Um seine Aufgaben zu erfüllen muss das Enzym jedoch erst aktiviert werden. Die Aktivierung gehorcht einem strengen zeitlichen Rhythmus, da sie in Anwesenheit von Licht vollständig ausgeschaltet ist.
p38 beeinflusst auch den 24-Stunden-Rhythmus der Fliege. Wenn die Wissenschaftler die Aktivität von p38 in den Uhren-Neuronen verringerten, waren die Fliegen abends länger aktiv: Ihr 24-Stunden-Rhythmus verlängerte sich deutlich auf mehr als 25 Stunden. Interessanterweise beobachteten die Forscher das gleiche Phänomen, wenn sie die Konzentration von p38 erhöhten. Auch dieses Ergebnis kam für die Wissenschaftler unerwartet, denn sie hatten eigentlich das Gegenteil erwartet. „Vermutlich gibt es einen optimalen Level dieser p38-Variante und jegliche Abweichung, egal in welcher Richtung, hat den gleichen Effekt“, erklärt Charlotte Helfrich-Förster den Befund.
Die Verknüpfung zwischen Stress-System und innerer Uhr
„Diese Ergebnisse lassen den Schluss zu, dass die Mitogen-aktivierte Proteinkinase p38 eine wichtige Komponente der inneren Uhr von Drosophila ist“, fassen die Wissenschaftler die Ergebnisse ihrer Arbeit zusammen.
Darüber hinaus konnten die Wissenschaftler zeigen, dass p38 sogar das Uhren-Protein Period reguliert und auf diese Weise die Geschwindigkeit der regelmäßigen molekularen Veränderungen direkt beeinflusst. „Dies kann erklären, warum die Fliegen ihre Aktivität nach hinten verschieben und sich ihr Rhythmus auf 25 Stunden verlängert, wenn p38 manipuliert wird“, so die Forscher.
Und da Stress ebenfalls p38 aktiviert, könne dieser auch die innere Uhr verstellen. Die MAP-Kinase p38 stellt also eine Verbindung zwischen dem Stress-System und der inneren Uhr her.
Julius-Maximilians-Universität Würzburg, 15.09.2014
Originalartikel:
The MAP Kinase p38 Is Part of Drosophila melanogaster’s Circadian Clock. Verena Dusik, Pingkalai R. Senthilan, Benjamin Mentzel, Heiko Hartlieb, Corinna Wülbeck, Taishi Yoshii, Thomas Raabe, Charlotte Helfrich-Förster. DOI: 10.1371/journal.pgen.1004565

