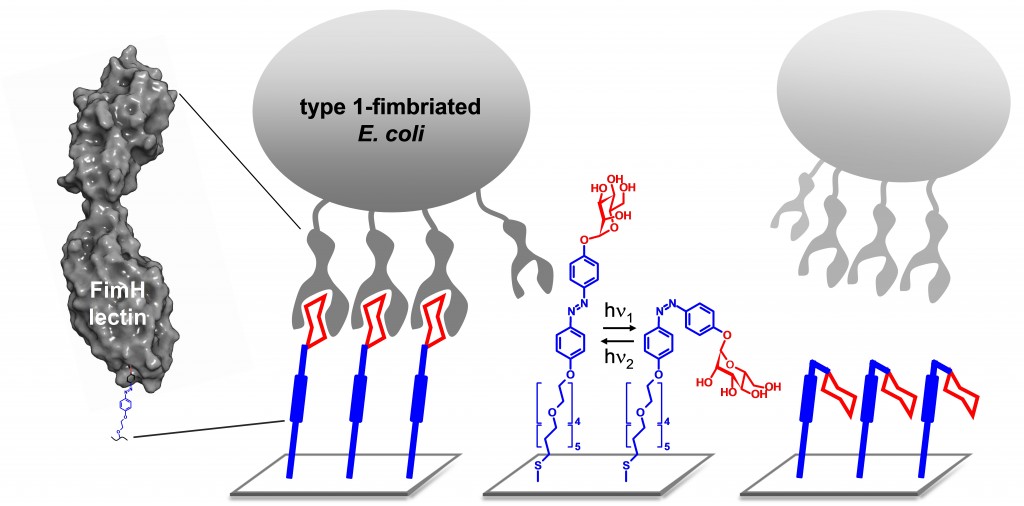
Links: E. coli-Bakterien können über das Protein FimH an den Zuckermolekülen der künstlichen Glycokalix andocken. Rechts: Bei Bestrahlung mit Licht einer Wellenlänge von 365 Nanometern knicken die Zuckermoleküle auf der Oberfläche weg und können von den Proteinen nicht erkannt werden. Die Bakterien können dann nicht mehr an die „Wirtszelle“ andocken.
Abbildung/Copyright: Wiley-VCH Verlag GmbH & Co. KGaA. Reproduced with permission.
Einem Forschungsteam ist es gelungen eine künstliche Oberfläche zu schaffen, auf der die Anheftung von E. coli-Bakterien kontrolliert werden kann. Die nur etwa vier Nanometer dünne Schicht ist ein Modellsystem der Glycokalyx, dem Zuckermantel von Zellen, an den Bakterien bei einer Infektion binden. Bei dem künstlichen System lässt sich das Andocken der Bakterien durch Licht ein- und ausschalten. Mithilfe dieser künstlichen Glycokalyx wollen die Forscher herausfinden, wie die Zuckermoleküle auf der Zelloberfläche bei Infektionen mit Bakterien interagieren.
Die Mechanismen, die Zellen erlauben sich an andere Zellen oder an Oberflächen anzuheften sind für Organismen lebenswichtig. Sie spielen eine wichtige Rolle bei der Entwicklung innerer Organe und Gewebe. Aber sie sind auch an der Entstehung von Krankheit und Infektionen beteiligt. So können die in den Bindungsexperimenten eingesetzten E. coli-Bakterien Harnwegsinfektionen, Hirnhautentzündungen, Sepsis und andere gravierende Krankheiten auslösen. Um diese Erkrankungen verstehen und behandeln zu können, müssen Forscher die molekularen Vorgänge verstehen, die es Bakterienzellen ermöglichen, an ihre Wirtszellen anzudocken.
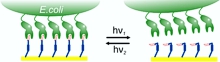
Kontrollierte Bindung: Die Anheftung von Bakterien an Zuckermolekülen auf dem Glycokalyx-Modell kann durch Licht umkehrbar gesteuert werden.
Abbildung/Copyright: Wiley-VCH Verlag GmbH & Co. KGaA. Reproduced with permission.
Häufig geschieht dies über Proteine, die nach einem komplizierten „Schlüssel-Schloss-Prinzip“ mit Kohlenhydratstrukturen auf der Wirtszelloberfläche wechselwirken. Wie die Forschungsergebnisse nun erstmals zeigen ist dafür die räumliche Ausrichtung der Kohlenhydratstrukturen entscheidend. Die natürliche Glycokalyx, die alle Zellen umgibt, ist eine nur wenige Nanometer dünne Schicht aus langen, mehrfach verzweigten Zuckermolekülen. Sie ist in ihrer Struktur viel zu komplex, um herauszufinden, wie Proteine und Kohlenhydrate zueinanderfinden.
Die Chemikerin Thisbe Lindhorst und ihr Team von der Uni Kiel hat Moleküle entwickelt, die durch eine Bestrahlung mit Licht verschiedener Wellenlängen als biologische Schalter funktionieren. Die Wissenschaftler setzen diese Moleküle ein einem künstlichen System ein, in dem die Ausrichtung der Zucker-Bindungsstellen und damit das Andocken der E. coli-Bakterien kontrolliert werden kann. Dazu beschichteten die Forscher eine extrem dünne Goldoberfläche mit einem genau definierten Zuckermantel, bei dem die Zuckermoleküle über Azobenzol an die Oberfläche gekoppelt sind. Das ist ein Kohlenwasserstoff, der eine Stickstoffbrücke enthält, die lichtgesteuert wie ein Gelenk funktioniert. Darüber lässt sich die Zugänglichkeit der Bindungsstellen des Zuckermantels an- und abschalten: Bei einer Bestrahlen mit Licht von 365 Nanometern Wellenlänge, können sich die Bakterien nur schlecht an die künstliche Oberfläche anheften. Denn die Bindungsstellen der Zuckermoleküle sind in diesem Fall von den Bakterien weg geklappt, so dass die Bakterien sie nicht mehr erkennen können. Beim „Einschalten“ mit 450 Nanometer langen Lichtwellen werden die Andockstellen auf den Zuckermolekülen wieder nach außen geklappt, so dass sie für die Bakterienzellen wieder zugänglich werden und diese erneut binden können. So lässt sich mit dem System die Anheftung von E. coli kontrollieren.
Rastertunnelmikroskopaufnahme von einer Kultur Escherichia Coli
Quelle: NIAID
„Durch den Einsatz eines Schichtsystems auf einer festen Oberfläche in Kombination mit einem Photo-Gelenk lässt sich die komplexe Dynamik einer realen Glycokalyx auf die wesentlichen Prozesse reduzieren und so verstehen“, erklärt Terfort. „Dieser neue Ansatz sollte sich auch auf andere biologische Grenzflächensysteme übertragen lassen.“
„Anhand unseres Modellsystems lassen sich Erkennungs- und Bindungseffekte der Glycokalyx sehr definiert und unter einem ganz neuartigen Blickwinkel untersuchen“, sagt Lindhorst. „Wenn wir lernen, die Glycokalyx in einem Zusammenhang von Gesundheit und Heilung zu beeinflussen, wird dies zu einer Revolution in der Medizinischen Chemie führen.“
Christian-Albrechts-Universität zu Kiel, 02.12.2014
Originalpublikation
Switching of bacterial adhesion to a glycosylated surface by reversible reorientation of the carbohydrate ligand. Theresa Weber, Vijayanand Chandrasekaran, Insa Stamer, Mikkel B. Thygesen, Andreas Terfort and Thisbe K. Lindhorst. Angew. Chem. 48/2014. DOI: 10.1002/ange.201409808 und 10.1002/anie.201409808 (Angew. Chem. Int. Ed.)

