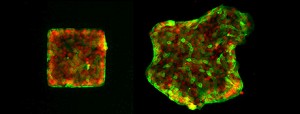
Epithelzellen bewegen sich aus einer ursprünglichen Form (links) kollektiv in die Umgebung (rechts). Die Lokalisation von Merlin ist grün markiert, rot zeigt die Zellkerne. © Max-Planck-Institut für Intelligente Systeme
Wissenschaftler haben einen molekularen Mechanismus der kollektiven Zellmigration entschlüsselt, der beispielsweise für die Wundheilung von Bedeutung ist. Ist dieser Mechanismus gestört, so kommt es nicht nur zu Problemen bei der Wundheilung, sondern auch zu Störungen in der Embryonalentwicklung und Krebszellen können sich leichter im Körper ausbreiten.
Damit sich Wunden wieder verschließen können, müssen Zellen gemeinsam und koordiniert in eine Richtung wandern. Bislang war nicht bekannt, wie hierzu die Bewegung der Zellen über größere Entfernungen auf molekularer Ebene koordiniert wird. Wissenschaftler der Universität Heidelberg und des Stuttgarter Max-Planck-Instituts für intelligente Systeme konnten nun den zugrunde liegenden Mechanismus entschlüsseln. Die kollektive Zellmigration spielt nicht nur bei der Wundheilung eine wichtige Rolle, sondern auch bei der Embryonalentwicklung und der Entstehung von Krebs.
„Die kollektive Bewegung von Zellen und biologischen Systemen ist eines der wichtigsten natürlichen Phänomene und kommt auf verschiedenen Ebenen und Längenskalen der Natur vor. Wir haben nun den molekularen Hauptakteur und den entsprechenden Mechanismus identifiziert, der die kollektive Migration von Epithelzellen, also Zellen des Deckgewebes von Haut, steuert“, erklärt Joachim Spatz vom Physikalisch-Chemischen Institut der Universität Heidelberg und dem Max-Planck-Institut für Intelligente Systeme. Die Wissenschaftler haben einen molekularen Mechanismus aufgedeckt, bei dem das Protein Merlin, abgekürzt für Moesin-Ezrin-Radixin-Like Protein, eine zentrale Rolle spielt. Die Ergebnisse stellen eine Verbindung zwischen den in einer einzelnen Zelle auftretenden mechanischen Kräften und der kollektiven Zellbewegungen her und zeigen so, wie lokale Interaktion in einer Zelle zu einer kollektiven Dynamik auf der multizellulären Ebene führen. „Damit schaffen sie eine Analogie zu dem, was man bereits von den kollektiven Bewegungen weiß, die sich in der biologischen und physikalischen Welt beobachten lassen“, erklärt Spatz.
Die Zellmigration vergleicht der Wissenschaftler mit den Abläufen bei einem Marathon: „Auf der Ebene des gesamten Organismus versucht ein Individuum in einer Menge ganz bewusst, seine Bewegungen an denen seiner Nachbarn auszurichten, wofür Wahrnehmung und Aktion miteinander in Einklang gebracht werden müssen.“ Innerhalb eines Zellkollektivs sind diese beiden Vorgänge durch synchron aktivierte Signalübertragungswege in den beteiligten Zellen miteinander verbunden. In einem Zellkollektiv gibt es eine Führungszelle, ähnlich dem Führenden in einem Marathonlauf. Sie ist mit den ihr folgenden Zellen mechanisch durch Zell-Zell-Kontakte verbunden. Durch das Voranlaufen der Führungszelle wird mechanische Spannung auf die Verfolgerzellen ausgeübt, wie Joachim Spatz erläutert. Das Protein Merlin registriert diese mechanische Spannung und leitet die räumlich polarisierte Verfolgungsbewegung ein. So wird die mechanische Spannung im Verfolgerfeld von einer Zelle zur nächsten weitergegeben. Die Verfolgerzellen reagieren darauf mit der Ausbildung von „Bein“-artigen Ausstülpungen in Richtung der Führungszelle, um sich nach vorne zu bewegen.
„Unklar war bisher, durch welche molekulare Verbindung diese beiden Ereignisse, Wahrnehmung und Aktion, verbunden sind“, sagt Joachim Spatz. „Dazu zeigt nun unsere Studie, wie Merlin als ein mechanosensitives Protein zelluläre Kräfte in kollektive Zellbewegungen umwandelt, indem es als mechanisch-chemischer Signalumwandler agiert. Erstaunlich ist dabei, dass Merlin das einzige Protein in dem verantwortlichen Signalnetzwerk ist, welches diese Eigenschaft in Zellkollektiven vermittelt – dass es also keine Ersatzmechanismen gibt. Fällt Merlin aus, verlieren Zellen die Fähigkeit, sich kollektiv zu bewegen, und verursachen die damit verbundenen medizinisch relevanten, pathophysiologischen Merkmale von Organismen.“
So überrascht es nicht, dass Defekte in Merlin, als bekanntem Tumorsuppressor für verschiedene Krebsarten verantwortlich sind. Zudem ist Merlin an der Steuerung des sogenannten Hippo-Signalwegs beteiligt, einem für die Biologie wichtigen Signalweg, der die Vermehrung von Zellen und die Größe von Organen steuert und seit dem Auftreten von frühen Vielzellern evolutionär konserviert ist. „Es ist spannend zu sehen, dass es mit dem von Merlin vermittelten Signalmechanismus eine Verbindung zwischen diesen scheinbar ungleichen Aspekten zu geben scheint“, sagt der Forscher.
Universität Heidelberg, 23. Februar 2015
Originalpublikation:
T. Das, K. Safferling, S. Rausch, N. Grabe, H. Boehm, J. Spatz: A molecular mechanotransduction pathway regulates collective migration of epithelial cells. Nature Cell Biology (published online 23 February 2015), doi: 10.1038/ncb3115

