Alzheimer Palques bestehen aus Proteinaggregaten von Beta-Amyloid- (Aβ)-Peptiden. Sie werden oft auch als Plaques bezeichnet. © KGH. Wikimedia Commons. CC BY-SA 3.0
Seit Jahren gelten sie als Auslöser degenerativer Nervenleiden: Proteinaggregate in Gehirn. Sie werden für Alterskrankheiten wie Alzheimer, Parkinson und Chorea Huntington verantwortlich gemacht. Doch manche Arten von Proteinablagerungen könnten auch ihr Gutes haben, wie Wissenschaftler nun herausgefunden haben. Im Laufe des Alterns lässt die Qualitätskontrolle bei der Proteinproduktion deutlich nach, was zu Fehlern bei der Proteinfaltung führt. Um sich vor den negativen Wirkungen der falsch gefalteten Proteine zu schützen lagern gesund alternde Zellen diese Proteine in einen Art Mülldeponie aus.
Wenn unsere Zellen altern nimmt mit der Zeit deren Fähigkeit, die Qualitätskontrolle der hergestellten Protein zu gewährleisten ab. Dadurch kommt es zu einer Ansammlung falsch gefalteter Proteine, die miteinander verklumpen. Bisher ging man davon aus, dass die so entstandenen großen, unlöslichen Proteinaggregate der Grund für altersbedingte Krankheiten wie Alzheimer, Parkinson und Chorea Huntington sind. Diese Art von massiven Proteinablagerungen hat man jedoch auch bei Menschen gefunden, die im hohen Alter ohne jegliche Demenzsymptome verstorben sind. Das ergab etwa die sogenannte Nonnenstudie, bei der katholische Ordensschwestern einwilligten, sich nach ihrem Tod obduzieren zu lassen. Einige von ihnen bewahrten sich bis ins hohe Alter eine erstaunliche geistige Leistungsfähigkeit. Umso überraschter waren die Forscher, als sie bei der Obduktion feststellen mussten, dass sich auch in ihren Gehirnen eine Vielzahl von Proteinablagerungen fand. Aufgrund dieser Erkenntnisse gehen viele Wissenschaftler inzwischen davon aus, dass es nicht die großen Proteinaggregate sind, die unsere Zellen, allen voran die Nervenzellen, schädigen, sondern wesentlich kleinere Proteinablagerungen, die sogenannten Oligomere.
Sind die Zellen mit zunehmendem Alter immer weniger dazu in der Lage die Bildung falsch gefalteter Protein zu verhindern lagern diese sich zu Oligomeren zusammen. Um diese möglicherweise gefährlichen, kleinen Aggregate unschädlich zu machen entsorgen die Zellen sie in größeren, unlöslichen Aggregaten, sozusagen einer Art Mülldeponie für Proteine. So verhindern sie, dass diese defekten Partikel unkontrolliert in der Zelle herum schwimmen und Schaden anrichten können. So jedenfalls lautet die Hypothese der Forscher vom Max-Planck-Institut für Biochemie in Martinsried bei München.
Untersucht haben die Forscher diese Prozesse am Fadenwurm Caenorhabditis elegans. Der nur etwa 1 mm lange Wurm ist ein bei Wissenschaftlern beliebter Modellorganismus, da er aus nur 959 Zellen besteht, deren Funktion man genau kennt, aber dennoch klare Organstrukturen besitzt und über ein Nerven-, Muskel- und Darmsystem verfügt. Da die Tiere schnell altern und nur etwa 20 Tage alt werden eigenen sie sich gut für die Erforschung von Alterungsprozessen.
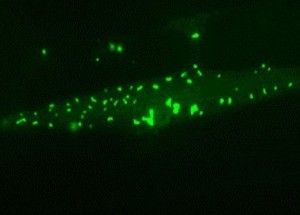
Muskelzelle eines langlebigen Fadenwurms: Chaperon-reiche Proteinaggregate (grün) reichern sich an und schützen die Zelle im Alter.
© Max-Planck-Institut für Biochemie / Prasad Kasturi
Für ihre Experimente untersuchten die Forscher mehr als 5000 verschiedene Proteine von kurz- und langlebigen Fadenwürmern zu mehreren Zeitpunkten im Verlaufen ihres kurzen Lebens. Dabei beobachteten sie, dass die langlebigen Tiere, die im Schnitt circa 30 Tage alt wurden große Mengen an Proteinablagerungen in ihren Zellen anhäuften, während die kurzlebigeren Varianten weniger Proteinaggregate entwickelten. Dabei fanden sich in den Proteinaggregaten der langlebigeren Würmer besonders viele Chaperone. Das sind Proteine, die dafür sorgen, dass andere Proteine richtig gefaltete werden, damit sie nicht verklumpen. Außerdem gewährleisten sie, dass die Zellen defekte Proteine abbauen können.
Die Wissenschaftler spekulieren, ob die Chaperone die vorliegenden Mülldeponien der Zellen quasi „versiegeln“, indem sie an die freien, aktiven Stellen der aus dem Aggregat herausragenden Proteinbereiche binden. So könnten die schädlichen Vorgänge, die sich an der Oberfläche großer Proteinablagerungen abspielen stark eingeschränkt werden. Diese Hypothese muss jedoch erst noch durch geeignete Experimente überprüft werden.
Vermutlich spielen bei diesen Prozessen die sogenannten kleinen Hitzeschockproteine eine wichtige Rolle. Sie lagern sich zu größeren Strukturen zusammen, so das sie mehrere falsch gefaltete Proteine zur gleichen Zeit binden können. Möglicherweise könnten diese Chaperone die Aggregation der falsch gefalteten Proteine fördern. Mutationen in kleinen Hitzeschockproteinen können zu Nervenkrankheiten führen.
Da die Forscher in den Aggregaten der langlebigen Fadenwürmer andere kleine Hitzeschockproteine gefunden haben, als bei den kurzlebigen Tieren vermuten sie, dass die Art der Hitzeschockproteine den Ausschlag dafür geben könnten, ob die Entsorgung der falsch gefalteten Proteine gelingt, ohne größeren Schaden in der Zelle anzurichten.
In wiefern sich die am Fadenwurm gewonnenen Erkenntnisse auf den Menschen übertragen lassen, muss erst noch durch weitere Experimente geklärt werden. Immerhin haben genetische Veränderungen, die beim Fadenwurm zu Langlebigkeit führen auch bei Mäusen eine verlängerte Lebensdauer zur Folge. Und auch im menschlichen Gehirn ist im Alter eine Klasse dieser kleinen Hitzeschockproteine besonders aktiv.
Allerdings ist auch nicht ausgeschlossen, dass sich die Aggregate nur einfach mit dem zunehmenden Alter der Zellen ansammeln und nicht ursächlich mit der Lebensdauer der Würmer zu tun haben. Auch dann würde man bei den langlebigeren Tieren mehr Aggregate finden, als bei den kurzlebigeren: Denn die länger lebenden Tiere haben einfach mehr Zeit, um mehr Aggregate anzusammeln. Weiter bestehen die Proteinaggregate bei den oben erwähnten altersbedingten neurodegenerativen Erkrankungen aus den Fragmenten eines bestimmten Proteins, wie etwa Aβ-Peptiden, während es sich bei den Proteinaggregaten der alternden Fadenwürmern um einen Mix aus verschiendsten falsch gefalteten Proteinen handelt. Es sind also noch einige Fragen offen, die durch gezielte Experimente geklärt werden müssen.
von Ute Keck
Originalpublikation:
Walther DM, Kasturi P, Zheng M, Pinkert S, Vecchi G, Ciryam P, Morimoto RI, Dobson CM, Vendruscolo M, Mann M and Hartl FU. Widespread Proteome Remodeling and Aggregation in Aging C. elegans. Cell, 7. Mai, 2015, DOI: 10.1016/j.cell.2015.03.032
Weiteres zum Thema Alterungsprozesse und Veränderungen bei der Proteinsynthese und deren -abbau beim Fadenwurm:

