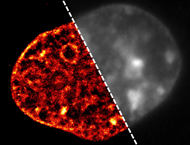
Das Bild der DNA einer Zelle, aufgenommen mit der am Institut für Molekulare Biologie entwickelten neuen superauflösenden Mikroskopietechnik, zeigt die DNA in scharfen Details (links). Im Gegensatz dazu ist das herkömmliche Mikroskopiebild verschwommen und macht eine Darstellung der auffälligen Veränderungen in der DNA, die von den Forschern am IMB entdeckt wurden, unmöglich (rechts). ©: Aleksander Szczurek, Ina Kirmes
Forscher haben untersucht, wie dramatisch sich ein Mangel an Sauerstoff und Nährstoffen auf Zellen auswirkt. Dieser „ausgehungerte“ Zustand ist typisch für weit verbreitete Erkrankungen wie Herzinfarkt, Schlaganfall und Krebs. Die Ergebnisse liefern neue Einblicke darüber, welche Schäden diese Krankheiten verursachen, und könnten zur Entwicklung neuer Behandlungsmethoden beitragen.
Wenn ein Mensch einen Herzinfarkt oder einen Schlaganfall erleidet, wird die Blutzufuhr zu der betroffenen Geweberegion unterbrochen. Dadurch kommt es zu einer Unterversorgung der Zellen mit Sauerstoff und Nährstoffen. Diese Mangeldurchblutung, die auch als Ischämie bezeichnet wird, kann langfristig irreparable Schäden nach sich ziehen. Ina Kirmes, Doktorandin in der Gruppe von George Reid am Institut für Molekulare Biologie in Mainz, hat untersucht, wie sich der Mangelzustand auf die DNA der betroffenen Zellen auswirkt.
In einer gesunden Zelle sind große Teile der DNA offen zugänglich, sodass viele Gene abgelesen werden können. Wie die Forscher zeigen konnten, verändert sich die Anordnung der DNA bei einer Ischämie deutlich: Die DNA verdichtet sich. Mit dramatischen Folgen: Die Gene in solchen kompakten Regionen können von der Zelle nicht mehr abgelesen werden. Dadurch ist die Aktivität der Zelle massiv vermindert. Wird die Blutversorgung nicht rechtzeitig wieder hergestellt, so fährt die Zelle schließlich ihren Betrieb herunter oder stellt ihn ganz ein, indem sie den programmierten Zelltod einleitet. Wenn etwa Herzzellen nicht mehr richtig funktionieren, hört dieser Teil des Herzmuskels auf, sich zusammenzuziehen, und das Herz versagt. Gleiches gilt für das Gehirn: Ist die Blutzufuhr zu Zellen unterbrochen und damit auch die Zufuhr von Nährstoffen, so sterben die Nervenzellen ab.
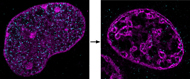
Dramatische Effekte der Ischämie: Die beiden Bilder zeigen DNA in einem Zellkern unter normalen (links) und ischämischen (recht) Bedingungen. Die am Institut für Molekulare Biologie entwickelte neue Technik für superauflösende Mikroskopie zeigt, dass sich die DNA zu ungewöhnlichen, engen Haufen verdichtet, wenn die Zellen nicht mit Sauerstoff und Nährstoffen versorgt sind. ©: Aleksander Szczurek, Ina Kirmes
„Bei einem Schlaganfall oder bei einem Herzinfarkt passiert wahrscheinlich genau dies mit der DNA“, erklärt George Reid. „Da wir jetzt wissen, was in der Zelle geschieht, können wir nach Wegen suchen, dieser Verdichtung der DNA vorzubeugen.“
Für ihre Untersuchungen nutzten die Forscher eine neue Methode, mit der die DNA in der Zelle in bisher unerreichter Genauigkeit dargestellt werden kann. Einer Weiterentwicklung der superauflösenden Lichtmikroskopie. Hierbei werden blinkende Farbstoffe eingesetzt, die an die DNA binden und so verraten wo sich einzelne Moleküle in den Zellen befinden.
Universität Mainz, 09.1..2015
Originalpublikation:
I. Kirmes et al. (2015), A transient ischemic environment induces reversible compaction of chromatin, Genome Biology 16:246, DOI:10.1186/s13059-015-0802-2
D. Żurek-Biesiada et al. (2015), Localization microscopy of DNA in situ using Vybrant® DyeCycle™ Violet fluorescent probe: A new approach to study nuclear nanostructure at single molecule Resolution, Experimental Cell Research, DOI:10.1016/j.yexcr.2015.08.020

