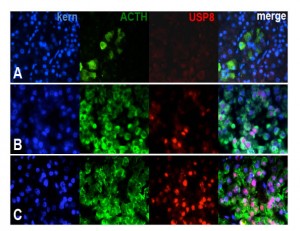
Die Abbildungen zeigen die Folgen von Mutationen im USP8-Gen, die zu einer Überproduktion von Adrenocorticotropin (ACTH) Cushing-Adenomen der Hirnanhangsdrüse führen. (A) zeigt ACTH-produzierende Zellen in der normalen Hypophyse; (B) den USP8-Wildtyp (B) und (C) bei mutierten USP8. Blau=Kernfärbung, Grün=ACTH-Färbung, Rot=USP8-Färbung und merge= Überlappung der drei Färbungen. © Silviu Sbiera
Gutartige Tumoren in der Hirnanhangsdrüse können ein Grund für eine ungebremste Ausschüttung des Stresshormons Cortisol durch die Nebennieren sein. Einem internationalen Forscherteam ist es nun gelungen, die dahinter stehenden molekularen Prozesse zu entschlüsseln.
Patienten, die an einem Cushing-Syndrom erkrankt sind, erkennt man oft schon an ihren äußerlichen Veränderungen: Sie leiden in der Körpermitte unter einer deutlichen Gewichtszunahme, haben ein rundes Gesicht und einen kräftigen Nacken. Neben diesen äußerlichen Anzeichen entwickeln die Betroffenen meist einen hohen Blutdruck, Muskelschwäche, Diabetes, sind extrem anfällig für Infekte, haben ständig Durst und bekommen oft Osteoporose. In der Regel lässt sich das Cushing-Syndrom leicht durch eine Operation behandeln. Bleibt die Krankheit dagegen unbehandelt, so sterben die Patienten an Infekten oder Herz-Kreislauf-Erkrankungen.
Bei der Suche nach den Auslösern dieser Krankheit ist ein internationales Forscherteam jetzt einen Schritt weiter gekommen. Es konnte auf molekularer Ebene einen Mechanismen aufdecken, der dazu führt, dass gutartige Tumore der Hirnanhangsdrüse das Cushing-Syndrom auslösen.
Permanente Cortisolausschüttung
Eine Übermaß eines Hormons ist der Auslöser sämtlicher Symptome des Cushing-Syndroms: Cortisol – in der Umgangssprache auch Kortison genannt. Das Stresshormon spielt im Stoffwechsel des Menschen eine wichtige Rolle. Wenn es jedoch in zu großer Menge ausgeschüttet wird, stürzt es den Organismus ins Chaos. Die Cortisolausschüttung wird in der Nebenniere von einem weiteren Hormon gesteuert: dem Adrenocorticotropin (ACTH), das in der Hirnanhangsdrüse produziert wird. Bildet sich dort ein gutartiger Tumor, so produziert die Drüse ungebremst ACTH und treibt auf diese Weise den Cortisolspiegel in die Höhe. Wie das genau geschieht, war bisher noch unklar.
„Wir konnten jetzt erstmals zeigen, dass in den Tumorzellen bei mehr als einem Drittel der Patienten eine spezielle Genveränderung eines Enzyms vorliegt, der sogenannten Ubiquitin-spezifischen Protease 8“, erklärt Martin Fassnacht, Professor an der Medizinischen Klinik I des Universitätsklinikums Würzburg. Ausgangspunkt dieser Entdeckung war eine genetische Charakterisierung von gutartigen Hirnanhangsdrüsentumoren, die ACTH produzieren. Bei vier der zehn untersuchten Tumoren fanden die Forscher eine Mutation in der Ubiquitin-spezifischen Protease 8.
Der entdeckte Gendefekt hat eine fataler Kettenreaktion zur Folge
Die Ubiquitin-spezifische Protease 8, kurz USP8, spielt eine Schlüsselrolle beim Recyceln nicht mehr benötigter Proteine. Das gilt auch für den Epidermal-Growth-Factor-Rezeptor: Dieser wird immer dann in der Zelle abgebaut und entsorgt, wenn das USP8-Gen gerade inaktiv ist. Wie die Wissenschaftler zeigen konnten, bewirkt die Genmutation, dass USP8 ständig angeschaltet bleibt. Dadurch werden die eigentlich nicht mehr benötigten Epidermal-Growth-Factor-Rezeptoren immer wieder recycelt anstatt, wie eigentlich vorgesehen, entsorgt zu werden. In einer lebensbedrohlichen Kettenreaktion wird so zuerst ACTH, und schließlich auch Cortisol im Übermaß produziert. „Die USP8-Mutationen stellen eine bedeutende Entdeckung dar. Sie eröffnen ganz neue diagnostische und therapeutische Ansätze zur Behandlung des Cushing-Syndroms“, sagt Martin Reincke.
Weitere Gendefekte beim Cushing-Syndrom
Bei der Suche nach den Ursachen des Cushing-Syndroms war das gleiche Forscherteam in diesem Jahr bereits mehrfach gemeinsam erfolgreich. So war es ihnen beispielsweise gelungen, Mutationen in einem Gen der Nebenniere als häufige Ursache für eine krankhaft gesteigerte Cortisolausschüttung auszumachen. Über die Ergebnisse dieser Arbeit berichteten sie im Februar im New England Journal of Medicine. Und erst vor wenigen Tagen konnten sie in der Fachzeitschrift Nature Communications weitere Entdeckungen publizieren: Dafür haben sie die genaue Wirkweise der Mutation in der Nebenniere weiter entschlüsselt.
Ludwig-Maximilians-Universität München, 09.12.2014
Originalpublikationen:
Martin Reincke, Silviu Sbiera, Akira Hayakawa, Marily Theodoropoulou, Andrea Osswald, Felix Beuschlein, Thomas Meitinger, Emi Mizuno-Yamasaki, Kohei Kawaguchi, Yasushi Saeki, Keiji Tanaka, Thomas Wieland, Elisabeth Graf, Wolfgang Saeger, Cristina L Ronchi, Bruno Allolio, Michael Buchfelder, Tim M Strom, Martin Fassnacht & Masayuki Komada. Mutations in the deubiquitinase gene USP8 cause Cushing’s disease. Nature Genetics, doi:10.1038/ng.3166
Beuschlein F, Fassnacht M, Assié G, Calebiro D, Stratakis CA, Osswald A, Ronchi CL, Wieland T, Sbiera S, Faucz FR, Schaak K, Schmittfull A, Schwarzmayr T, Barreau O, Vezzosi D, Rizk-Rabbin M, Zabel U, Szarek E, Salpea P, Forlino A, Vetro A, Zuffardi O, Kisker C, Diener S, Meitinger T, Lohse MJ, Reincke M, Bertherat J, Strom TM, Allolio B. Constitutive Activation of PRKACA in Adrenal Cushing’s Syndrome.
N Eng J Med 2014 epub 2014, Feb, 26. DOI: 10.1056/NEJMoa1310359
Davide Calebiro, Annette Hannawacker, Sandra Lyga, Kerstin Bathon, Ulrike Zabel, Cristina Ronchi, Felix Beuschlein, Martin Reincke, Kristina Lorenz, Bruno Allolio, Caroline Kisker, Martin Fassnacht & Martin J. Lohse. PKA catalytic subunit mutations in adrenocortical Cushing’s adenoma impair association with the regulatory subunit. DOI: 10.1038/ncomms6680 in Nature Communications

