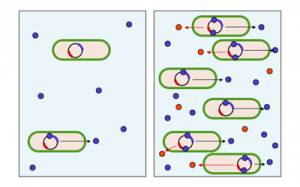
Schema des Quorum sensings,
links: Konzentration an Autoinduktormolekülen (blau) gering,
rechts: Konzentration an Autoinduktormolekülen hoch, bakterielles Produkt (rot) wird synthetisiert © Y_tambe. CC BY-SA 3.0
Bakterien können über chemische Signale miteinander kommunizieren. Durch diese Art von „Absprache“ können sie ihr Verhalten an ihre Pupulationsdichte anpassen. Über diesen Quorum sensing genannten Prozess entfalten Krankheitserreger oft erst ihre pathogene Wirkung. Wissenschaftler haben nun einen neuen Kommunikationsweg entdeckt, der weit verbreitet zu sein scheint.
Verschiedene Bakterien verfügen meist auch über unterschiedliche Kommunikationswege. Dem Team um Heermann an der Ludwig-Maximilian-Universität München ist es nun gelungen, einen neuen, weit verbreiteten bakteriellen Kommunikationsweg zu entschlüsseln.
Bisher ist die bakterielle Kommunikation über N-Acylhomoserinlaktone (AHL) am Besten erforscht: Dabei produziert das Enzym LuxI Signale, die von dem LuxR-Rezeptor erkannt werden. Daraufhin bilden die Bakterien bestimmte Eigenschaften aus und stimmen ihr Verhalten aufeinander ab. Diesen Quorum sensing genannten Vorgang setzten Bakterien dazu ein, um ihr Verhalten an ihre Populationsdichte anzupassen. Damit koordinieren sie die Ausprägung von Verhaltensweisen, die nur in einer größeren Gruppe Sinn machen, wie etwa die Bildung eines infektiösen Biofilms. Wenn die Konzentration der für die Kommunikation eingesetzten Moleküle bei höherer Zelldichte eine bestimmte Schwelle überschreitet, werden verschiedene Gene aktiviert. Das hat wiederum eine Synthese von Proteinen zur Folge, die zu einer Verhaltensänderung der Bakterien führt.
Die Forscher untersuchten Bakterien, die zwar einen LuxR-Rezeptor haben, nicht jedoch über das Enzym LuxI verfügen. Als Modellorganismus für ihre Untersuchungen wählten die Mikrobiologen das Bakterium Photorhabdus asymbiotica, einen für Insekten tödlichen Krankheitserreger, der auch Menschen befallen und Hautinfektionen verursachen kann. Diese Bakterien kommunizieren über das Signalmolekül Dialkylresorcinol. Es wird von ihrem LuxR-Rezeptor erkannt. „Bei diesem Quorum sensing ist der Einfluss auf die krankmachenden Eigenschaften der Bakterien äußerst stark. P. asymbiotica benötigt Dialkylresorcinol und damit die Kommunikation mit den Artgenossen für die erfolgreiche Infektion der Larve“, sagt Ralf Heermann.
Die Forscher haben den neu entdeckten Signalweg auch noch in einer Vielzahl weiterer Bakterien nachweisen können. Der neu entdeckte Signalweg scheint also weit verbreitet zu sein. „Wir konnten viele weitere humanpathogene Bakterien identifizieren, die ebenfalls kein LuxI aufweisen und auch die Fähigkeit zur Bildung dieses Signals besitzen“, sagt Helge Bode, Merck Stiftungsprofessor für Molekulare Biotechnologie an der Goethe-Universität Frankfurt und Koautor der Studie.
Neues Konzept der Bakterienbekämpfung
Die Erforschung der bakteriellen Kommunikation ist auch für die Bekämpfung von Krankheitserregern bei Menschen relevant. Denn die Kommunikationswege der Bakterien stellen einen möglichen Angriffspunkt für neue Medikamente dar. Wenn man die Kommunikation zwischen den Bakterien unterbindet, könnte man sie daran hindern ihre krankmachenden Eigenschaften ausbilden, so die Hoffnung der Forscher. „Wenn Krankheitserreger nicht mehr wie bisher durch Antibiotika abgetötet, sondern im Vorfeld an der Bildung krankmachender Eigenschaften gehindert werden könnten, würde das die Gefahr von Resistenzbildungen erheblich mindern“, sagt Helge Bode.
Ludwig-Maximilians-Universität München, 13.01.2015
Originalpublikation:
Brameyer S, Kresovic D, Bode HB, Heermann R. Dialkylresorcinols as bacterial signaling molecules. Proc Natl Acad Sci U S A. 2015 Jan 13;112(2):572-7. doi: 10.1073/pnas.1417685112. Epub 2014 Dec 30.

