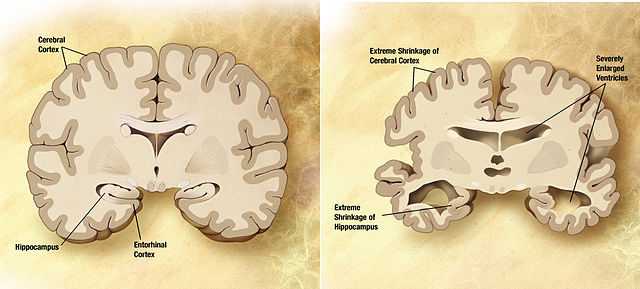
Vergleich des Gehirns eines an Alzheimer erkrankten Patienten (rechts) mit dem eines Gesunden (links). © public domain. Wikimedia Commons.
Seit Jahren stehen ß-Amyloid Proteine im Verdacht Alzheimer auszulösen. Sie kommen im Gehirn von Alzheimer-Patienten in Form von amyloiden Plaques vor. Doch auch bei Menschen, die sich ihre geistige Leistungsfähigkeit bis ins hohe Alter erhalten konnten, wurden solche Plaques mitunter in großer Zahl gefunden. Wie Forscher nun an zwei Tiermodellen gezeigt haben, könnten die ß-Amyloid-Peptide ein wichtiger Bestandteil der angeborenen Immunreaktion gegen Krankheitserreger im Gehirn sein. Das lässt die ß-Amyloid-Peptide in einem völlig neuen Licht erscheinen: Denn viele Ansätze zur Alzheimertherapie zielen darauf ab diese Proteine aus dem Gehirn zu entfernen. Doch wenn diese Proteine tatsächlich eine wichtige Rolle bei der Immunabwehr spielen, könnten diese Ansätze fatale Folgen haben.
ß-Amyloid Ablagerungen werden für die Alzheimer Erkrankung verantwortlich gemacht. Doch laut Rudolph Tanzi vom Massachusetts General Hospital (MGH) in Boston, USA, kommen solche Plaques auch in anderen Organen, wie dem Herzen, der Leber und der Niere vor. Auch dort stören sie die Funktion der betroffenen Organe. Deshalb stellten er und sein Team sich die Frage, warum dieses Protein, wenn es doch scheinbar so fatale Folgen hat, seit mindestens 400 Millionen Jahren von verschiedensten Tierarten produziert wird. Denn bereits im Devon lebende Fische, die Quastenflosser, verfügten über dieses Protein. Es wird von einem Gen abgelesen, das bei vielen Arten hoch konserviert ist. So treten etwa auch bei Hunden Alzheimer-artige Plaques auf und sie können im Alter an Demenz erkranken.
Wenn ß-Amyloid im Tierreich so weit verbreitet ist, sollte es eine wichtige Funktion haben. Bereits 2010 hatten Robert Moir und Rudolph Tanzi entdeckt, dass ß-Amyloid einem antimikrobiellen Peptid ähnelt: Damals verglichen die Forscher die Wirkung eines synthetisch hergestellten ß-Amyloid Peptids mit der eines bekannten antimikrobiellen Peptids, dem LL-37. Laut den Forschern hemmte ß-Amyloid das Wachstum einiger pathogener Bakterien, wie Listerien, Staphylokokken und Streptokokken genauso gut oder sogar besser als LL-37. Darüber hinaus konnte ß-Amyloid von Alzheimer-Patienten das Wachstum des Hefepilzes Candida albicans hemmen. Später fanden andere Forschergruppen heraus, dass ß-Amyloid auch gegen Influenza und Herpes-Viren wirkt.
Zur Abwehr von Bakterien und Viren verfügt unser angeborenes Immunsystem über ein spezialisiertes Arsenal an kurzen Eiweißmolekülen, den antimikrobiellen Peptiden, Ihr Wirkungsspektrum erstreckt sich von Bakterien, über behüllte Viren und Pilzen bis hin zu Tumorzellen. Diese Peptide sind zwischen 12 und 50 Aminosäuren lang. Zur besseren Interaktion mit der Membran der zu zerstörenden Eindringlinge besitzen sie über 50% hydrophobe, wasserabweisende Aminosäuren. Ihre geringe Größe, sowie ihre spezielle Aminosäuresequenz macht ihre räumliche Struktur äußerst flexibel. So nehmen sie ihre endgültige Form erst an, wenn sie an eine Biomembran binden. Viele dieser Peptide schädigen die Zellmembran von Krankheitserregern, etwa, indem sie diese durchlöchern. Oder sie dringen in die feindliche Zelle ein und legen sie dort lahm.
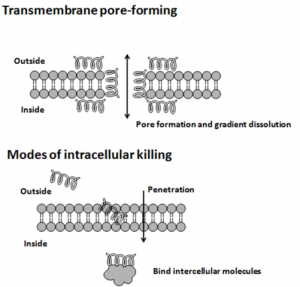
Wirkung Antimikrobieller Peptide. © Ymahn. CC BY-SA 3.0.
Antimikrobielle Peptide wirken unter anderem selektiv gegen bakterielle Zellen, indem sie viele positiv geladene Aminosäuren enthalten, die besonders gut an die negativ geladene bakterielle Zellwand binden.
Einige dieser Peptide bilden fibrilläre Aggregate, wie etwa LL-37. Diese Ablagerungen gehen mit vielen altersbedingten Autoimmunerkrankungen, wie Rheumatischer Arthritis, Lupus erythematodes und Atherosklerose einher. Die toxische Wirkung der Aggregate auf Zellen und die entzündungsfördernde Wirkung von LL-37 legt nahe, dass dieses antimikrobielle Peptid ein (Mit)verursacher der Erkrankungen sein könnte.
Als die Bostoner Forscher ihre neue Hypothese veröffentlichten wurden sie von den meisten Alzheimerforschern nicht erst genommen. Denn bisher ging man davon aus, dass ß-Amyloid eine Laune der Natur sei und keine wichtige Funktion erfüllt. Deshalb konzentrierten sich die bisherigen Bemühungen mehr darauf, wie man dieses in gleicher Weise nutzlose, wie schädliche Protein möglichst effektiv los werden kann, als darauf, seine natürliche Aufgabe zu entschlüsseln. Doch bereits 2010 vermuteten die Forscher, dass verschiedene Faktoren, die eine Überreaktion des angeborenen Immunsystems aktivieren zur Ablagerung von ß-Amyloid-Plaques führen. Zu diesen Faktoren zählen neben Infektionen des Gehirns auch Schädel-Hirn-Traumata und Schlaganfälle. Sie alle gelten als Risikofaktoren für Alzheimer.
ß-Amyloid soll die Nervenzellen schädigen. Bisher ging man davon aus, dass die ß-Amyloid-Plaques für die neurodegenerativen Prozesse bei Alzheimer verantwortlich sind. Doch wie die Nonnenstudie beweist, kommen solche Plaques auch bei Personen vor, die sich ihre geistige Leistungsfähigkeit bis ins hohe Alter erhalten konnten. Die ß-Amyloid-Peptide werden durch die Enzyme Beta- und Gamma-Sekretase aus einem Vorläuferprotein abgespalten. Im normalen Stoffwechsel werden diese Peptide ständig erzeugt, lagern sich jedoch nicht ab. Damit sich Ablagerungen bilden, müssen noch weitere Faktoren hinzukommen. Sie bilden sich etwa im Gehirn und in den Blutgefäßen von Alzheimerkranken und Down-Syndrom-Patienten. Bisher war bereits bekannt, dass ß-Amyloid Entzündungsreaktionen fördert. Doch man betrachtete diese Wirkung lediglich als einen schädlichen Nebeneffekt. Wenn ß-Amyloid jedoch die Rolle eines antimikrobiellen Peptids erfüllt, gehört es zu seinen natürlichen Aufgaben die Immunabwehr gegen fremde Eindringlinge einzuleiten und weitere Immunzellen an den Infektionsherd zu locken.
In ihrer neuen Studie konnten die Forscher nun am Tiermodell beweisen, dass ß-Amyloid tatsächlich bei der Immunabwehr hilft. Für ihre Versuche setzten die Forscher Mäuse ein, die eine große Menge an menschlichem ß-Amyloid bilden. Sie dienen als Modellsystem zur Erforschung von Alzheimer. Mit Hilfe dieser Mäuse wollten die Forscher heraus finden, ob Tiere, die mehr ß-Amyloid bilden eine durch das Bakterium Salmonella typhimurium hervorgerufene Meningitis besser abwehren können, als Wildtypmäuse. Das Ergebnis: In Tieren, die menschliches ß-Amyloid bildeten, vermehrten sich die Bakterien deutlich schlechter, in der Folge verloren die Tiere weniger Gewicht und überlebten im Schnitt rund 72 h, während die Wildtypmäuse, die nur über die Mausversion von ß-Amyloid verfügten, bereits 60 h nach der Infektion starben. In den Gehirnen der Mäuse fanden die Forscher viele Plaques aus ß-Amyloid, in deren Mitte sich jeweils ein Bakterium befand. Die Krankheitserreger waren also von ß-Amyloid umzingelt und festgesetzt worden.
C. elegans Fadenwürmer, die durch genetische Manipulation ein menschliches ß-Amyloid erhalten hatten schützte die Würmer vor einer Infektion mit dem Pilz Candida albicans und dem Bakterium Salmonella typhimurium.
Es spricht also einiges dafür, dass ß-Amyloid ein Teil des angeborenen Immunsystems ist und als antimikrobielles Peptid eine wichtige Rolle bei der Abwehr von verschiedenen Krankheitserregern spielt. Toxische Ablagerungen bilden sich bei diesem Prozess vermutlich nur, wenn die Peptide in so großer Menge gebildet werden, dass sie nach dem Abklingen der Infektion von den Fresszellen des Immunsystems nicht mehr richtig entsorgt werden können. Das könnte etwa auch bei chronischen Infektionen der Fall sein oder auch bei einer durch krankhafte Veränderungen hervorgerufenen fehlerhaften Aktivierung der Produktion und Freisetzung dieser Moleküle. Mäuse, denen die Beta-Sekretase zur Spaltung des ß-Amyloid-Vorläufers zu ß-Amyloid-Peptiden fehlte starben entweder in früher Jugend (40%) an einer Kachexie oder waren deutlich kleiner als ihre normalen Verwandten. Ursache hierfür könnte eine mangelhafte Immunabwehr gewesen sein. Es ist also Vorsicht angebracht, Alzheimer dadurch therapieren zu wollen, indem man das ß-Amyloid-Peptid aus dem Gehirn zu entfernen sucht.
Doch damit nicht genug: Auch andere Proteine, die sich bei neurodegenerativen Erkrankungen zu Aggregaten zusammen lagern, wie das Prion-Proteine bei der Creutzfeldt-Jacob-Erkrankung und das tau-Protein als Verursacher der Frontotemporalen Demenz mit Parkinson sollen animikrobielle Eigenschaften haben. Vielleicht gilt ähnliches auch für Parkinson und Chorea Huntington, Auch diese Erkrankungen gehen mit Proteinaggregaten im Gehirn einher.
Ob diese Proteinaggregate jedoch tatsächlich die Ursache der neurodegenerativen Erkrankungen sind oder ob es sich dabei oft nur um die Überreste vergangener Auseinandersetzungen mit mikrobiellen Eindringlingen handelt, muss erst noch genauer erforscht werden. Nicht jeder, der eine Infektion oder ß-Amyloid-Plaques im Gehirn hat entwickelt auch eine Demenz.
von Ute Keck, 1. Juni 2016
Originalpublikation:
Kumar DK, Choi SH, Washicosky KJ, Eimer WA, Tucker S, Ghofrani J, Lefkowitz A, McColl G, Goldstein LE, Tanzi RE, Moir RD. Amyloid-β peptide protects against microbial infection in mouse and worm models of Alzheimer’s disease. Sci Transl Med. 2016 May 25;8(340):340ra72. doi: 10.1126/scitranslmed.aaf1059.

