Neurone.© Lee W-CA, Huang H, Feng G, Sanes JR, Brown EN, So PT, et al. (2006) Dynamic Remodeling of Dendritic Arbors in GABAergic Interneurons of Adult Visual Cortex. PLoS Biol 4(2): e29. doi:10.1371/journal.pbio.0040029
Viele neurodegenerative Erkrankungen gehen mit Proteinablagerungen einher. Lange glaubte man, diese Proteinaggregate seien das Ergebnis fehlerhafter Proteinfaltung. Doch in den letzten Jahren häufen sich Hinweise, dass die Aggregation der beteiligten Proteine zu deren natürlicher Funktion gehört: Denn sie sind Teil der angeborenen Immunantwort. Sie setzen Bakterien, Viren oder Pilze fest, indem sie diese durch ein Netzwerk an Aggregaten unbeweglich machen. Darüber hinaus hemmen sie deren Wachstum oder töten sie ab indem sie Poren in deren Membran formen. Gleichzeitig locken sie Zellen der Immunabwehr an den Ort des Geschehens. Unter normalen Bedingungen gelingt so eine erfolgreiche Infektionsabwehr. Schießt diese Reaktion jedoch über ihr Ziel hinaus oder wird sie chronisch, wird auch das umliegende Gewebe, in diesem Fall das Gehirn, geschädigt.
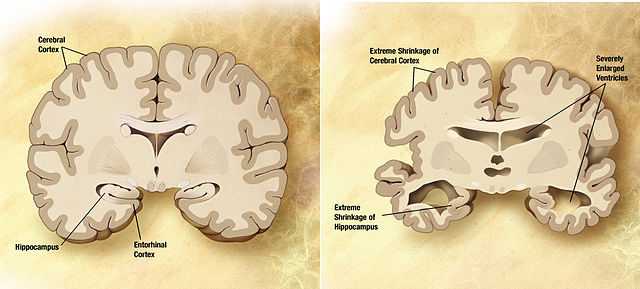
Vergleich des Gehirns eines an Alzheimer erkrankten Patienten (rechts) mit dem eines Gesunden. © public domain. Wikimedia Commons.
Die Liste der neurodegenerative Erkrankungen, bei denen sich Proteinablagerungen im Gehirn bilden, ist lang. Sie unterscheiden sich durch ihre Symptome und die in den Aggregaten vorhandenen Proteine. Doch bei allen vermutet man, dass die Krankheiten durch die verschiedenen Protein-Ablagerungen hervorgerufen werden. Aggregate aus β-Amyloid, dem tau-Protein und α-Synuclein werden für die Alzheimer-Erkrankung verantwortlich gemacht. Durch die Zerstörung des Hippocampus leiden die Patienten unter fortschreitendem Gedächtnisverlust. Mutationen in Huntingtin führen zu amyloidartigen Ablagerungen des fehlerhaften Proteins und sind vermutlich Grund für die Erbkrankheit Chorea Huntington. Durch die fortschreitende Zerstörung des Striatums fällt den Betroffenen die Steuerung ihrer Muskeln und die Ausübung grundlegender mentale Funktionen immer schwerer. Bei der Pick-Krankheit kommt es zu einer Degeneration des Stirn- bzw. Schläfenlappens. Deshalb ändert sich bei den Erkrankten die Persönlichkeit und ihre sozialen Verhaltensweisen. Bei rund der Hälfte der Patienten findet man Plaques aus dem Protein TDP-43. Die Creutzfeldt-Jakob-Erkrankung wird auf die Aggregate des Prion-Proteins zurückgeführt. Die Verbreitung dieser Proteine in Rinderherden machte als BSE-Krise Schlagzeilen.
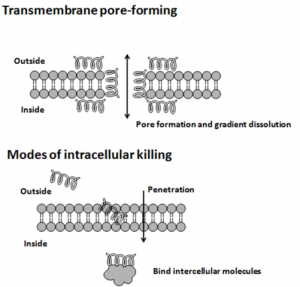
Wirkung Antimikrobieller Peptide. © Ymahn. CC BY-SA 3.0.
Seit langem vermutete man, dass diese und ähnliche Erkrankungen auf fehlgeleitete Immunreaktionen zurückgehen, die zu einem Absterben von Nervenzellen führen. In den letzten Jahren gibt es immer mehr Indizien dafür, dass diese Proteine Teil des angeborenen Immunsystems sind. Die Aufgabe solcher antimikrobiellen Peptide besteht darin, sich durch eine Änderung ihrer räumlichen Struktur an die Membranen von Bakterien, behüllten Viren oder Pilzen anzulagern, um diese in ihrem Wachstum zu hemmen. Diese Peptide sind zwischen 12 und 50 Aminosäuren lang. Zur besseren Interaktion mit der Membran der zu zerstörenden Eindringlinge besitzen sie über 50% hydrophobe, wasserabweisende Aminosäuren. Ihre geringe Größe, sowie ihre spezielle Aminosäuresequenz macht ihre räumliche Struktur äußerst flexibel. So nehmen sie ihre endgültige Form erst an, wenn sie an eine Biomembran binden. Viele dieser Peptide schädigen die Zellmembran von Krankheitserregern, etwa, indem sie diese durchlöchern. Oder sie dringen in die feindliche Zelle ein und legen sie dort lahm.
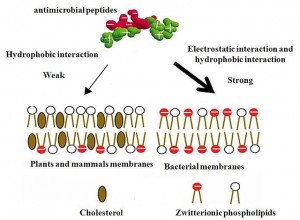
Mechnismus der Selektivität mikrobieller Peptide.
Doch um Poren zu bilden müssen sich mehrere dieser Peptide aneinander lagern. Oder sie müssen miteinander aggregieren, um die Membran der Krankheitserreger schädigen zu können. Aufgrund der Unterschiede zwischen den Zellmembranen des Wirts und der Bakterien wirken die antimikrobiellen Peptide weitestgehend selektiv gegen die Erreger. Mit ihren vielen positiv geladenen Aminosäuren binden sie besonders gut an die negativ geladene bakterielle Zellwand. Die Außenseite von Säugerzellen ist dagegen ungeladen. Darüber hinaus ist die Membran der Wirtszellen durch Cholesterin stabilisiert.
Toxische Ablagerungen bilden sich bei diesem Prozess vermutlich nur, wenn die Peptide in so großer Menge gebildet werden, dass sie nach dem Abklingen der Infektion von den Fresszellen des Immunsystems nicht mehr richtig entsorgt werden können. Das könnte etwa bei chronischen Infektionen der Fall sein oder bei einer durch krankhafte Veränderungen hervorgerufenen fehlerhaften Aktivierung der Produktion und Freisetzung dieser Moleküle. Einige dieser Peptide bilden fibrilläre Aggregate, wie etwa LL-37. Diese Ablagerungen gehen mit vielen altersbedingten Autoimmunerkrankungen, wie Rheumatischer Arthritis, Lupus erythematodes und Atherosklerose einher. Die toxische Wirkung der Aggregate auf Zellen und die entzündungsfördernde Wirkung von LL-37 legt nahe, dass dieses antimikrobielle Peptid ein (Mit)verursacher der Erkrankungen sein könnte.
Und so könnten auch die Ablagerungen der im Gehirn wirkenden antimikrobiellen Peptide, die man im Zusammenhang mit vielen neurodegenerativen Erkrankungen findet der Grund für das massive Absterben von Nervenzellen sein. Allerdings müssen weitere Untersuchungen erst noch zeigen, ob diese Hypothese tatsächlich stimmt, oder ob es sich bei den Aggregaten nur um die Überreste vergangener Auseinandersetzungen des Wirts mit Krankheitserregern handelt, die jedoch dem Gehirn nicht schaden.
von Ute Keck, 2. Juni 2016
Originalpublikationen:
Harris F, Dennison SR, Phoenix DA. Aberrant action of amyloidogenic host defense peptides: a new paradigm to investigate neurodegenerative disorders? FASEB J. 2012 May;26(5):1776-81. doi: 10.1096/fj.11-199208. Epub 2012 Feb 3.
Kumar DK, Choi SH, Washicosky KJ, Eimer WA, Tucker S, Ghofrani J, Lefkowitz A, McColl G, Goldstein LE, Tanzi RE, Moir RD. Amyloid-β peptide protects against microbial infection in mouse and worm models of Alzheimer’s disease. Sci Transl Med. 2016 May 25;8(340):340ra72. doi: 10.1126/scitranslmed.aaf1059.
Bandea CI. 2013. Aβ, tau, α-synuclein, huntingtin, TDP-43, PrP and AA are members of the innate immune system: a unifying hypothesis on the etiology of AD, PD, HD, ALS, CJD and RSA as innate immunity disorders. bioRxiv. doi: 10.1101/000604
Beatman EL, Massey A, Shives KD, Burrack KS, Chamanian M, Morrison TE, Beckham JD. Alpha-Synuclein Expression Restricts RNA Viral Infections in the Brain. J Virol. 2015 Dec 30;90(6):2767-82. doi: 10.1128/JVI.02949-15.
Kobayashi N, Masuda J, Kudoh J, Shimizu N, Yoshida T.
Binding sites on tau proteins as components for antimicrobial peptides. Biocontrol Sci. 2008 Jun;13(2):49-56.
Kallberg Y1, Gustafsson M, Persson B, Thyberg J, Johansson J. Prediction of amyloid fibril-forming proteins. J Biol Chem. 2001 Apr 20;276(16):12945-50. Epub 2000 Dec 27. doi: 10.1074/jbc.M010402200
Torrent M1, Pulido D, Nogués MV, Boix E. Exploring new biological functions of amyloids: bacteria cell agglutination mediated by host protein aggregation. PLoS Pathog. 2012;8(11):e1003005. doi: 10.1371/journal.ppat.1003005. Epub 2012 Nov 1.

