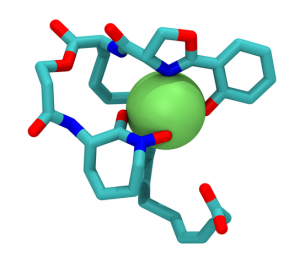
Mycobactin T , ein bakterielles Siderophor, mit Eisenion. © gemeinfrei.
Pathogene Keime greifen auf unsere Eisenvorräte zurück, wenn sie sich in uns vermehren. Diesem Angriff ist unser Körper jedoch nicht hilflos ausgeliefert. Er wehrt sich indem er seine Eisenresourcen vor dem Zugriff der Bakterien schützt. Wissenschaftler haben nun einen weiteren Mechanismus entdeckt mit dem die Krankheitskeime versuchen an unsere Eisenvorräte heranzukommen.
Fast alle Organismen sind auf Eisen angewiesen um wachsen zu können. Denn Eisen ist ein bedeutender Cofaktor für die verschiedensten Proteine, die in unserem Körper wichtige Funktionen erfüllen. Ohne das Eisen im Hämoglobin könnte kein Sauerstoff zu unseren Zellen transportiert werden und anschließend das als Abfallprodukt der Zellatmung angefallene Kohlendioxid wieder abtransportiert werden. Ohne Eisen könnten unsere Zellen keine Energie aus unserer Nahrung gewinnen. Denn die an der Zellatmung beteiligten Hämoproteine benötigen Eisen um zu funktionieren. Ohne sie könnten die Mitochondrien, die Energiekraftwerke unserer Zellen, die aufgenommenen Nährstoffe nicht in die Energiewährung der Zelle, nämlich Adenosintriphosphat (ATP) umwandeln. Selbst die DNA-Synthese ist ohne Eisen nicht möglich, da auch die dafür zuständigen Proteine Eisen in ihrem reaktiven Zentrum verwenden.
Nicht anders ergeht es den meisten Keimen. Auch sie können ohne Eisen nicht wachsen. Ihre Energiegewinnung ist von eisenhaltigen Proteinen genauso abhängig wie unsere Mitochondrien. Und ohne genügend Eisen können sie ihre DNA für die Vermehrung nicht verdoppeln, da dann ihre DNA-Synthesemaschinerie lahm gelegt ist. Deshalb haben Bakterien verschiedene Strategien entwickelt, um an den essentiellen Nährstoff Eisen heranzukommen. Eine davon besteht in der Bildung von sogenannten Siderophoren. Das sind sehr kleine, nur aus wenigen Aminosäuren bestehende Peptide, die von den Bakterien ausgeschieden werden, um das Eisen ihrer Umgebung zu binden. Siderophore sind nur zwischen 300 bis 2000 Dalton groß. Ihre geringe Größe einen guten Grund. Denn um das Eisen aufnehmen zu können müssen die Bakterien die kleinen mit Eisen beladenen Moleküle durch die engen Kanäle ihrer beiden Zellwände transportieren.
Die meisten Eisentransportproteine höherer Lebewesen sind dagegen wesentlich größer. Das menschliche Transferrin etwa hat einer Größe von 75.200 Dalton. Bakterielle Siderophore haben eine wesentlich höhere Affinität gegenüber Fe3+ als die Siderophore des Menschen. Das versetzt Bakterien dazu in die Lage Eisen in unserem Körper von Proteinen wie Transferrin abzuziehen und für ihre eigenen Zwecke zu nutzen.
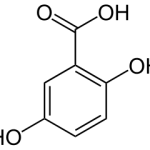
Struktur von Gentisinsäure (2,5-Dihydroxybenzoesäure). © gemeinfrei.
Als nahe Verwandte der Bakterien besitzen unsere Mitochondrien einen eigenen Mechanismus, um Eisen herbei zu schaffen: ein mitochondrielles Siderophor namens Gentisinsäure. Die Mitochondrien der Säugetiere sind Zellkompartimente, die von einer eigenen Membran umschlossen sind und der Energiegewinnung dienen. Sie stammen ursprünglich von Bakterien ab, die vor langer Zeit ihre Unabhängigkeit verloren haben, um ein untrennbarer Bestandteil unserer Zellen zu werden. Vor kurzem konnten Devireddy und sein Team von der Case Western Reserve University in Cleveland, USA zeigen, dass Bakterien dazu in der Lage sind mit Eisen beladene Gentisinsäure aufzunehmen und als Eisenquelle zu nutzen. Sie sind also nicht nur auf ihre eigenen Siderophore angewiesen, sondern können zusätzlich auch noch auf die Siderophore ihres Wirts zurückgreifen. Damit stehen ihnen verschiedenste Möglichkeiten zur Verfügung, um an genügend Eisen für ihre exponentielle Vermehrung heranzukommen.
Devireddy und sein Team fanden heraus, dass die Synthese von Gentisinsäure während einer bakteriellen Infektion herabgesetzt ist. Der Wirtsorganismus scheint also die Produktion des eigenen Siderophors zu drosseln, um den Bakterien die lebenswichtige Resource Eisen zu entziehen. Wie von den Forschern vermutet konnten denn auch Mäuse deren Gen zur Bildung von Gentisinsäure zerstört war und denen folglich dieses Siderophor fehlte eine Bakterieninfektion mit E. coli besser abwehren, als normale Mäuse.
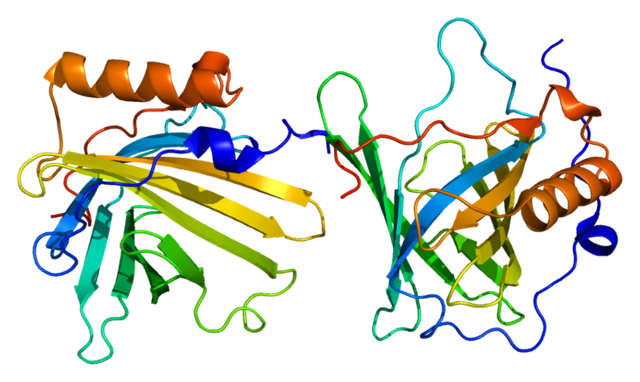
Lipocalin-2. © Emw. CC BY-SA 3.0.
Aber unser Körper hat noch einen anderen Abwehrmechanismus gegen die Eisenräuber auf Lager. Als Reaktion auf eine bakterielle Infektion bilden Zellen unseres Immunsystems ein Peptid namens Lipocalin-2, das sowohl die bakteriellen als auch die eigenen Siderophore aus dem Verkehr zieht. Lipocaline sind Proteine, die bestimmte Moleküle binden, im Falle von Lipocalin-2 die Siderophore und sie dann in die Zelle transportieren. Fast alle Lebewesen verfügen über Lipocaline. Diese Proteine besitzen eine Art Trichter mit dem sie wasserunlösliche Moleküle aufnehmen und den sie mit einer Art Deckel verschließen können. Anschließend dockt das beladene Lipocalin an einen Rezeptor an der Oberfläche einer Zelle an, der es dann ins Zellinnere befördert. So zieht Lipocalin-2 die Siderophore samt dem gebunden Eisen aus dem Verkehr und sammelt es in dem für das Bakterium unzugänglichen Inneren der Zellen an.
Unser Körper verfügt also über zwei Mechanismen mit denen er den Eisendiebstahl der Bakterien entgegenwirkt. Einerseits fährt er die Synthese seines eigenen Siderophors Gentisinsäure herunter und andererseits produziert er große Mengen Lipocalin-2. Auf diese Weise sorgt er dafür, dass den Bakterien für ihre Vermehrung weniger Eisen zur Verfügung steht und er so die Bakterieninfektion besser in den Griff bekommen kann.
Bevor wir jedoch versuchen zur Bekämpfung von Infektionskrankheiten gezielt in diesen Kampf ums Eisen einzugreifen sollten wir die komplexen Zusammenhänge dieses Mechanismus erst noch besser verstehen. So könnte eine Förderung der Lipocalin-2-Produktion zwar dazu führen, dass außerhalb der Zellen lebende Bakterien sich nicht mehr vermehren können. Dafür könnten dann aber Bakterien, die sich im Zellinneren vermehren, wie etwa Mycobacterium tuberculosis, der Erreger der Tuberkulose, von dem erhöhten Eisengehalt im Inneren der Zellen profitieren und sich verstärkt teilen. Diese Bakterien können jahrelang in den Makrophagen, den Fresszellen des Immunsystems, in einem Ruhezustand verharren, um sich dann, wenn es dem Wirt schlechter geht, zu vermehren. Weiter ist bei einer Förderung der Lipocalin-2-Produktion auch zu berücksichtigen, dass Lipocalin-2 ein Biomarker für chronisches Nierenversagen ist, eine Rolle bei der Krebsentstehung und bei der Knochengewebemodellierung spielt. Im Knochen soll es die Differenzierung der Osteoklasten, der knochenabbauenden Zellen fördern und die Reifung der Osteoblasten, der knochenaufbauenden Zellen und deren Funktion hemmen. Mäuse, die Lipocalin-2 überexprimieren bleiben kleiner als normale Mäuse und haben dünnere Knochen. Auch wäre zu klären, welche Rolle die Siderophore der Säugetiere in unserm Eisenhaushalt unter normalen Bedingungen und während einer bakteriellen Infektion spielen und welche Bedeutung sie für unser Immunsystem, die Bildung der roten Blutkörperchen und andere eisenabhängige zelluläre Prozesse haben.
von Ute Keck
Zhuoming Liu, Scott Reba, Wei-Dong Chen, Suheel Kumar Porwal, W. Henry Boom, Robert B. Petersen, Roxana Rojas, Rajesh Viswanathan, and L. Devireddy: Regulation of mammalian siderophore 2,5-DHBA in the innate immune response to infection. J Exp Med 2014, 211:1197-1213, doi: 10.1084/jem.20132629
Costa D Lazzarini E et al. (November 2013). Altered bone development and turnover in transgenic mice over-expressing lipocalin-2 in bone. . J. Cell. Phis. 228 (11): 2210–21. doi:10.1002/jcp.24391. PMID 23606520

