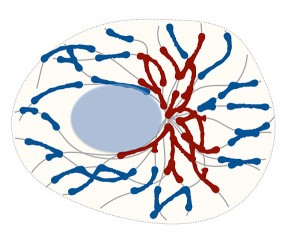
Das Zellskelett (graue Linien) beeinflusst die Fusion der Mitochondrien. Es teilt sie in faserige Netzstrukturen (rot) und kleinere Fragmente (blau) und formt so deren Netzwerk. © HZI / Sukhorukov
Mitochondrien sind die Kraftwerke der Zellen. Sie kontrollieren die Energieproduktion und sind an einigen wesentlichen zellulären Prozessen beteiligt. Ist ihre Funktion gestört, so kann dies gravierende Folgen haben, wie etwa das Auftreten von Krankheiten, den sogenannten Mitochonriopathien. Dabei handelt es sich in erster Linie um neurologische oder muskuläre Erkrankungen, aber auch manche Alterungsprozesse sind durch mitochondrielle Fehlfunktionen bedingt. Mit einem neuen mathematischen Modell konnten System-Biologen nun beschreiben, wie die dynamische Bildung und Aufrechterhaltung der Mitochondrien-Netzwerke in einer Zellen abläuft.
Mitochondrien sind nicht etwa statische Strukturen, sondern sehr dynamisch: Sie bilden ein sich ständig wandelndes Netzwerk, das sich im Minutentakt verändert. Laufend teilen sich die Mitochondrien und fusionieren anschließend wieder miteinander. Dabei ist ihre räumliche Struktur dafür verantwortlich, wie effektiv sie Energie liefern können: Faserige, miteinander verbundene Netzstrukturen sind dazu in der Lage viel Energie zu produzieren, kleinere Fragmente sind dagegen weniger effektiv. „Auch bei der Zellalterung spielen solche Prozesse eine Rolle. Gestresste oder geschädigte Mitochondrien werden fragmentiert und anschließend entsorgt“, sagt Valerii Sukhorukov, Wissenschaftler in der Abteilung System-Immunologie am Helmholtz Zentrum für Infektionsforschung.
Wie jedoch entsteht ein dynamisches Gleichgewicht zwischen den kleinen Fragmenten und den effektiven vernetzten Fasern der Mitochondrien? Das ist die zentrale Frage, die die Forscher zu beantworten suchten. „Solche Mechanismen können nicht allein über biochemische Analysen studiert werden. Man braucht dafür modellbasierte Simulationen am Computer, die die dynamischen Veränderungen in der Zelle gut erklären“, sagt Michael Meyer-Hermann, Leiter der Abteilung System-Immunologie.
Dazu entwickelten die Wissenschaftler ein mathematisches Modell, das die unterschiedlichen Längen der Mitochondrien-Fragmente in linearer oder verzweigter Anordnung berechnete. Dabei fanden die Forscher heraus, dass die Dynamik der Mitochondrien in einer Zelle sich nur dann korrekt simulieren lässt, wenn man die zufälligen Bewegung der Mitochondrien entlang der Fasern des Zellskeletts, den Mikrotubuli, berücksichtigt. Dazu entwickelten die Forscher ein sogenanntes Graphenmodell, das auf der Dichte der Mikrotubuli und deren Überkreuzungen in der Zelle basiert. Es beschreibt alle bisher experimentell gefundenen Formen von Mitochondrien und liefert darüber hinaus Erklärungen für bisher noch nicht verstandene Ereignisse.
Sukhorukov und seine Kollegen möchten in Zukunft das neue mathematische Modell dazu nutzen, um die Qualitätskontrolle der fragmentierten Mitochondrien zu untersuchen und zu verstehen, wie die Zellen Schäden in Mitochondrien überprüfen oder beseitigen. „Dies wäre sehr wichtig, um zu verstehen, wie Zellen ihren Energiehaushalt trotz einer Ansammlung von Schäden mit dem Alter kontrollieren. Daraus könnten wir Rückschlüsse über bestimmte genetisch bedingte Krankheiten wie Parkinson und über Alterungsprozesse im Immunsystem ziehen“, sagt Sukhorukov.
Helmholtz Zentrum für Infektionsforschung, 10.09.2015
Originalpublikation:
Valerii M. Sukhorukov, Michael Meyer-Hermann. Structural Heterogeneity of the Mitochondria Induced by the Microtubule Cytoskleleton. Scientific Reports. 2015 Sep 11. 5:13924. DOI: 10.1038/srep13924

