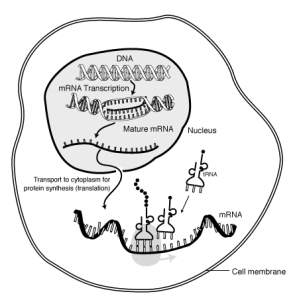
Rolle der mRNA in einer eukaryotischen Zelle: Im Zellkern wird die Erbinformation DNA in RNA transkribiert. Nachdem die Intronbereiche herausgeschnitten wurden wird die prozessierte mRNA in das Cytoplasma transportiert, wo an den Ribosomen durch Translation die Proteinsynthese erfolgt.
Die Erbanlagen vieler Viren bestehen aus Ribonukleinsäure, abgekürzt RNA. Aber auch unser Körper produziert RNA, die der viralen RNA sehr stark ähnelt. Dennoch kann unser Immunsystem virales Erbgut von körpereigener RNA unterscheiden. Forscher haben nun herausgefunden, wie das funktioniert. Demnach trägt unsere eigene RNA an ihrem Kopfende eine molekulare Markierung, die sie bei einer Art „Passkontrolle“ in der Zelle vorzeigt. Dieser Mechanismus erlaubt es der Zelle ihre eigene RNA von viraler RNA zu unterscheiden. So wird verhindert, dass das Immunsystem durch die zelleigene RNA aktiviert wird. Allerdings gibt es Viren, die die Kontrolle durch eine raffinierte Passfälschung unterlaufen.
RNA-Viren, die Krankheiten wie Grippe, Gelbfieber oder Ebola verursachen, sind keine selbständig lebensfähigen Organismen. Sie brauchen für ihre Vermehrung lebende Zellen. Denn RNA-Viren transportieren lediglich virale Erbinformationen in Form von RNA – sie enthalten also nicht mehr als ihre eigene Bauanleitung. Bei einer Infektion schleusen sie ihre RNA in die Zelle ein. Diese wird dadurch quasi umprogrammiert und bildet nun viele Viren-Bestandteile, die sie zu Viruspartikeln zusammenbaut. Sie verlassen die Zelle um neue Wirtszellen zu infizieren. Erst mit Hilfe der infizierten Zelle kann sich das Virus also vermehren.
Um Viren an ihrer Vermehrung zu hindern, müssen Zellen virales Erbgut erkennen können. Diese Erkennung erfolgt in der infizierten Zelle im sogenannten Cytoplasma. Allerdings nutzen Zellen auch selbst RNA, etwa als Bauanleitung für körpereigene Proteine. Virale RNA ist der körpereigenen RNA sehr ähnlich. Wie gelingt es dem Immunsystem also, die wenigen Kopien viraler RNA im Meer körpereigener RNA zu erkennen?
Molekulare Passkontrolle durch RNA-Rezeptoren
Die Erkennung viraler RNA im Cytoplasma erfolgt durch zwei sogenannte RNA-Rezeptoren: RIG-I und MDA5. Während die Funktionsweise von MDA5 noch unklar ist, ist man bei RIG-I einige Schritte weiter: Wie bei einer Passkontrolle am Flughafen das Gesicht kontrolliert wird, überprüft RIG-I das Kopfende von RNAs. Denn in diesem Bereich unterscheiden sich die virale und die körpereigene RNA: Während die körpereigene RNA an ihrem Kopfende als Markierung eine Kappe (engl. Cap) trägt, die meist aus einem modifizierten Guanin–Nukleotid besteht, fehlt diese bei einigen Viren.
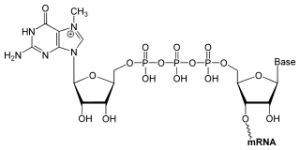
Ein modifiziertes Guanin-Nukleotid dient als mRNA-Cap. © public domain.
Diese Kappe erhöht nicht nur die Stabilität der RNA drastisch, sondern sie ist auch wichtig für den Transport der RNA aus dem Kern in das Cytoplasma und die darauf folgende Translation der mRNAs durch die Ribosomen. Wie die Forscher nun zeigen konnten verhindert diese Kappe an der zellulären RNA außerdem die Bindung an das Kontrollprotein RIG-I. Damit wird gewährleistet, dass RIG-I durch die körpereigene RNA nicht aktiviert werden kann.
Sobald jedoch eine virale RNA an RIG-I andockt löst dies eine Aktivierung des Immunsystems aus. Bei dieser Immunantwort werden einerseits antivirale Mechanismen in der Zelle selbst aktiviert. Zum anderen werden Nachbarzellen alarmiert und Immunzellen angelockt, die eine Ausbreitung des Virus verhindern und nach erfolgreicher Bekämpfung des Virus ein immunologisches Gedächtnis aufbauen.
Doch wie verhindert die Kappe die Bindung an RIG-I? RIG-I trägt eine Struktur, die beim Bindungsvorgang mit der Kappe räumlich kollidiert. Diese Struktur muss sich in der Evolution sehr früh herausgebildet haben, denn bereits die evolutionsbiologisch alte Seeanemone verfügt über eine Markierung ihrer eigenen RNA. Folglich besitzen auch alle Wirbeltiere eine solche Kappe am Kopfende ihrer RNA.
Manche Viren unterlaufen die Passkontrolle
Manchen Viren gelingt es jedoch, diesen Kontrollmechanismus zu unterlaufen. So fügt etwa das Gelbfieber-Virus die Kappe selbst in seine RNA ein und mogelt sich so durch die Passkontrolle. Die Forscher hoffen nun, diese Erkenntnis für die Entwicklung von neuen Medikamenten nutzen zu können, die diesen Tarnmechanismus angreifen. Doch bis dahin ist es noch ein weiter Weg.
Rheinische Friedrich-Wilhelms Universität Bonn, 14.07.2015
Originalpublikation:
A Conserved Histidine in the RNA Sensor RIG-I Controls Immune Tolerance to N1-2′O-Methylated Self RNA; Immunity, doi: 10.1016/j.immuni.2015.06.015

