Krebsstammzellen. © Jas. CC-by-sa 2.0
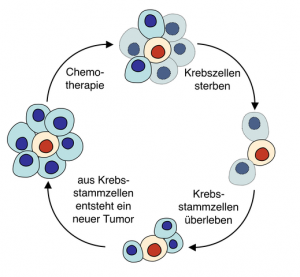
Die Stammzellen in unserem Knochenmark bilden ständig neue Blutzellen. Doch in seltenen Fällen können sie auch Tumoren bilden. Durch eine Therapie kann die Zahl der normalen Tumorzellen stark reduziert werden, nicht jedoch die der Krebsstammzellen. Forscher haben nun ein mathematisches Modell entwickelt, mit dem sie den Anteil der Krebsstammzellen im Verlauf einer Krebserkrankung berechnen können. Diese Zellen spielen für die Krebserkrankung eine zentrale Rolle, weil sie die Zellen darstellen, die für die Bildung neuer Tumorzellen verantwortlich sind und dadurch ein erneutes Tumorwachstum ermöglichen. Während die Anzahl aller Tumorzellen im Laufe einer Behandlung bestimmter Leukämien oft sinkt, bleibt die relative Anzahl der Krebsstammzellen meist konstant. Das Modell der Forscher könnte Medizinern bei der Voraussage der Tumorentwicklung unterstützen und damit die Wahl einer passenden Therapie erleichtern.
Krebszellen sind entartete, sich unkontrolliert teilende Körperzellen. In vielen Geweben gibt es Stammzellen, die zeitlebens neue Zellen bilden. Blutzellen beispielsweise werden von Stammzellen im Knochenmark laufend nachgebildet. Im Falle einer Leukämie führen genetische Veränderungen der Stammzellen zu unkontrolliertem Wachstum. Bereits im letzten Jahr hatten Mathematiker ermittelt, dass die Häufigkeit verschiedener Tumorarten von der Teilungsrate der Stammzellen des jeweiligen Gewebes abhängt. Demnach hängt die Wahrscheinlichkeit an Krebs zu erkranken weitgehend vom Zufall ab und ist damit oft ganz einfach persönliches Pech.
„Zwar machen letztendlich die Stammzellen nur einen kleinen Teil eines Tumors aus –wie groß dieser ist, wissen wir aber noch nicht“, so Benjamin Werner vom Zentrum für Evolutions- und Krebsforschung in London und ehemaliger Mitarbeiter am Max-Planck Institut für Evolutionsbiologie.
Nun haben die Forscher ein mathematisches Modell mithilfe von medizinischen Daten von Leukämiepatienten entwickelt. Die Forscher haben die Verlaufskurven der Krebsentwicklung während einer Behandlung mit dem Krebsmedikament Imatinib analysiert und den Schweregrad der Krankheit ermittelt. Das Computermodell berechnete auf Basis dieser Zahlen den Anteil an Krebsstammzellen, die man aufgrund der Daten im Körper der Patienten erwarten würde. Demzufolge nahm die Anzahl an Krebszellen nach einem Behandlungsjahr um das Hundertfache ab. Der Anteil der Tumorstammzellen stieg entsprechend an. Nach fünf Jahren Behandlung kletterte ihr Anteil sogar auf das Tausendfache.
Der Effekt kommt dadurch zustande, dass die Zahl der Krebsstammzellen wesentlich langsamer sinkt, als die der übrigen Krebszellen. Angenommen zu Beginn der Behandlung liegt die Zahl der Krebszellen bei 100.000 und die der Krebsstammzellen bei 103. Sinkt dann nach einem Jahr der Behandlung die Zahl der Krebszellen auf 1000 und die Zahl der Krebsstammzellen auf 100, so hat sich der entsprechende relative Anteil der Krebsstammzellen von 0,1% im Lauf der Behandlung auf 9,3% erhöht. Absolut ist dabei die Zahl der Krebszellen etwa um das 100-fache zurück gegangen, wogegen sich die Zahl der Krebsstammzellen fast gar nicht verändert hat.
Da in das Modell keine Informationen über die Krebsart einfließen kann es für verschiedene Krebsformen eingesetzt werden.
„Krebsstammzellen fördern nicht nur das Wachstum eines Tumors. Sie können zudem gegenüber Strahlen- und Chemotherapie resistent sein. Wenn wir die Anzahl der Krebsstammzellen bei der Diagnose und im Verlauf einer Behandlung abschätzen können, kann die Therapie dementsprechend angepasst werden“, so Philipp Altrock vom Dana Farber Cancer Institute in Harvard, der Leiter der Studie. Dazu gehört etwa, wie aggressiv die Behandlung sein soll und wie lange sie andauern muss, sowie die Frage, welche Kombinationen an Medikamenten am effektivsten sind. „Patienten mit nur wenigen Krebsstammzellen könnten eventuell die Therapie abbrechen, Patienten mit vielen Krebsstammzellen hingegen könnten von einem anderen Therapieansatz profitieren“, erklärt Werner.
Das Modell ist derzeit noch nicht in der klinischen Anwendung. „Bis dies möglich ist, müssen wir es noch weiterentwickeln“, sagt Arne Traulsen vom Max-Planck-Institut für Evolutionsbiologie, der an der Studie beteiligt war. Die Autoren hoffen, die Methode in Zukunft auch auf solide Tumore anwenden zu können.
Max-Planck-Gesellschaft, 13. April 2016
Originalpublikation:
Benjamin Werner, Jacob G. Scott, Andrea Sottoriva, Alexander R.A. Anderson, Arne Traulsen, and Philipp M. Altrock. The cancer stem cell fraction in hierarchically organized tumors can be estimated using mathematical modeling and patient-specific treatment trajectories. Integrated Systems and Technologies: Mathematical Oncology doi: 10.1158/0008-5472.CAN-15-2069

