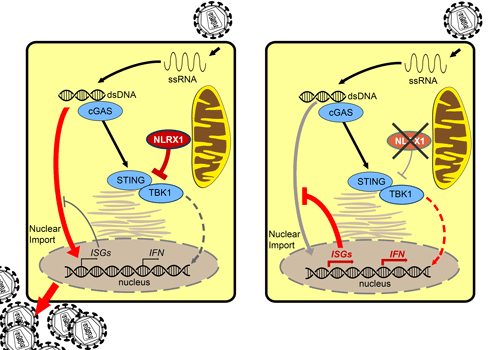
NLRX1 und HIV-1-Infektion a) NLRX1 hemmt Immunreaktionen, wodurch die HIV-Vermehrung ermöglicht wird. b) Wird NLRX1 ausgeschaltet, greifen die Schutzmechanismen und die HIV-Replikation ist blockiert. © PEI
Forscher haben ein Protein in menschlichen Zellen identifiziert, das für die Vermehrung des Humanen Immundefizienz-Virus (HIV) unverzichtbar ist. Es spielt eine Schlüsselrolle bei der Hemmung einer Reaktion des angeborenen Immunsystems gegenüber HIV-1. Die neuen Erkenntnisse eröffnen neue therapeutische Möglichkeiten.
Die besondere Pathogenität von HIV-1 besteht nicht darin, dass das Virus seine Wirtszelle so umprogrammiert, dass deren Proteine seiner eigenen Vermehrung dienen. Das ist allen Viren gemeinsam. Sondern es gelingt HIV darüber hinaus das menschliche Immunsystem lahm zu legen, so dass es sich unbehelligt vermehren kann. Ein Forscherteam um Renate König am Paul-Ehrlich-Institut befasst sich schon lange mit der Frage, warum das menschliche Immunsystem bei HIV-1 versagt. Diesen Mechanismus zu entschlüsseln könnte nicht nur dabei helfen neue Medikamente gegen HIV-1 sondern auch Wirkverstärker für zukünftige Impfstoffen zu entwickeln.
Das internationale Forscherteam hat nun entdeckt, dass das zelluläre Protein NLRX1 eine Schlüsselrolle bei der Unterdrückung der Immunreaktion gegen HIV spielt. Dieses Protein wirkt als Stellschraube, mit der das Frühwarnsystem des Immunsystems abgeschaltet werden kann.
Den Forschern zufolge ermöglicht NLRX1 in Immunzellen wie Makrophagen und Dendritischen Zellen, den Wächtern des Immunsystems, eine HIV-1-Infektion. Den meisten Viren gelingt es nicht Immunzellen selbst zu infizieren. Sie beschränken sich bei ihrer Vermehrung auf andere Körperzellen. Dieser Coup gelingt HIV nur, indem es das angeborene Immunsystem hemmt. Dazu sorgt es dafür, dass NLRX1 an das Protein STING binden. Auf diese Weise verhindert NLRX1, dass STING seine normale Aufgabe zur Aktivierung des Immunsystems erfüllt. Denn sowie das HIV-Virus in seiner Wirtszelle angekommen ist wird es von dem Rezeptor cGAS erkannt. Das ist für STING das Signal sich mit dem Faktor TBK1 zu verbinden und diesen zu aktivieren. Daraufhin bildet die Zelle Typ-I-Interferon und entzündungsfördernde Zytokine, um die Immunabwehr in Gang zu setzen. Darüber hinaus führt die Verbindung zwischen STING und TBK1 zu einer Aktivierung Interferon-stimulierender Gene, die das Einwandern der Virus-DNA in den Zellkern und damit seine Vermehrung verhindern. All diese Abwehrmechanismen des Immunsystems werden gehemmt, wenn NLRX1 an STING bindet. Schalteten die Forscher dagegen NLRX1 aus, so fiel die Zytokinantwort deutlich höher aus und die virale DNA konnte nicht in den Zellkern einwandern.
Damit ist NLRX1 eine interessante Zielstruktur für die Entwicklung von Therapien gegen HIV-1. Neuartige Therapeutika, die NLRX1 blockieren, könnten auch genutzt werden, um als Adjuvanzien die Wirksamkeit in Impfstoffen zu erhöhen. „“Wir glauben, dass unsere Forschungsergebnisse die Entwicklung solcher Wirkstoffe gegen HIV-1 beschleunigen kann, die dazu beitragen, die angeborene Immunantwort auf HIV-1 zu verstärken““, erläutert König die Bedeutung dieser Forschungsergebnisse.
Paul-Ehrlich Institut, 14.04.2016
Originalpublikationen:
Guo H, König R, Deng M, Riess M, Mo J, Zhang L, Petrucelli A, Yoh SM, Barefood B, Samo M, Sempowski GD, Zhang A, Colberg-Poley AM, Feng H, Lemon SM, Liu Y, Zhang Y, Wen H, Zhang Z, Damania B, Tsao LC, Wang Q, Su L, Duncan JA, Chanda SK, Ting JPY (2016): NLRX1 Sequesters STING to Negatively Regulate the Interferon Response, Thereby Facilitating the Replication of HIV-1 and DNA Viruses. Cell Host & Microbe 19: 515-528. DOI: http://dx.doi.org/10.1016/j.chom.2016.03.001
König R, Zhou Y, Elleder D, Diamond TL, Bonamy GMC, Irelan JT, Chiang C, Tu BP, De Jesus PD, Lilley CE, Seidel S, Opaluch AM, Caldwell J, Weitzman MD, Kuhen KL, Bandyopadhyay S, Ideker T, Orth A, Miraglia LJ, Bushman FD, Young JA, Chanda SK (2008): Global analysis of host-pathogen interactions that regulate early-stage HIV-1 replication. Cell 135: 49-60. doi: 10.1016/j.cell.2008.07.032

