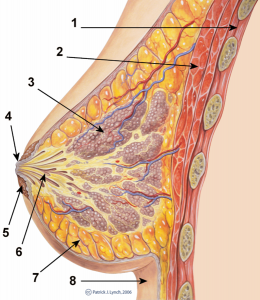
Schematischer Querschnitt durch die weibliche Brust: 1.Brustkorb 2. großer Brustmuskel 3. Brustdrüse 4. Brustwarze 5. Warzenhof 6. Milchgänge 7. Fettgewebe 8. Haut ©.Morgoth666. CC BY 3.0. Wikimedia Commons.
Forscher haben neue Mechanismen entdeckt, die bei der Metastasierung von Brustkrebs eine Rolle spielen. Die Krebszellen nutzen dabei einen Mechanismus, der während der Brustentwicklung und in der Schwangerschaft eine zentrale Rolle spielt.
Jahrzehntelang glaubte man, dass Krebszellen nur im Spätstadiun der Erkrankung, also von großen Tumoren aus streuen. Diese Annahme beruht auf der Beobachtung, dass eine frühe Diagnose und operative Entfernung mit einer längeren Lebenserwartung der Patienten einher geht. Doch mit dieser Theorie lässt sich nicht erklären, warum auch Patienten mit kleinen Tumoren gelegentlich Metastasen entwickeln. Darüber hinaus findet man bei einem genetischen Vergleich von gestreuten Krebszellen mit dem Primärtumor oft gravierende Unterschiede. Demnach scheinen gestreute Krebszellen, die Vorläufer von Metastasen, oft schon früh in dem Krebsstammbaum abzuzweigen. Das heißt, sie entstehen bereits zu einem frühen Zeitpunkt der Krankheitsentwicklung. Und schließlich fand man keinen Zusammenhang zwischen der Anzahl der gestreuten Krebszellen und der Tumorgröße. Vielmehr scheinen große Tumoren weniger zu streuen als kleine.
Ein Forscherteam um Christoph Klein in Regensburg und Julio Aguirre-Ghiso in New York haben nun physiologische Prozesse entdeckt, die bei der Brustkrebsentwicklung eine zentrale Rolle spielen: Dabei werden Mechanismen dereguliert und von den Tumorzellen ausgenutzt, die normalerweise die Ausbildung und Verzweigung der Milchgänge in der Pubertät und der Schwangerschaft steuern. Nachdem sie gestreut haben nisten sich die Zellen in anderen Körpergeweben ein und wachsen nach weiteren genetischen Veränderungen in den Zielorganen zu lebensbedrohlichen Metastasen heran. Beide Forscherteams waren zunächst unabhängig voneinander zu ähnlichen Ergebnis gekommen, kooperierten dann jedoch und haben ihre Ergebnisse nun gleichzeitig in »Nature« publiziert. »Unsere fundamental neuen Ergebnisse werden die Krebsforschung hoffentlich ein großes Stück voranbringen«, erklärt Klein.
Die Regensburger Forscher hatten schon vor Jahren gezeigt, dass Krebszellen bereits in einem frühen Stadium streuen. Sie wollten nun herausfinden, welche Mechanismen bei den frühen Brustkrebszellen aktiv sind, sowie ob und wenn ja, warum späte Tumoren diese Eigenschaft möglicherweise wieder verlieren, wenn sie eine bestimmte Größe überschritten haben. Dabei entdeckten sie, dass das Geschlechtshormon Progesteron in frühen Gewebeveränderungen eine zentrale Rolle spielt. In frühen Stadien der Krebsentwicklung liegt eine niedrige Zelldichte vor und das Onkogen HER2 ist moderat aktiv. In diesem Szenario bewirken die durch Progesteron hervorgerufenen Veränderungen eine gesteigerte Migration der Zellen. Gleichzeitig gewinnen sie Eigenschaften, die für sogenannte Stammzellen charakteristisch sind. Diese unsterblichen Zellen verfügen damit über alle wesentlichen Voraussetzung für eine Metastasierung. Paradoxerweise unterdrückt das gleiche Hormon bei fortgeschrittenen Tumoren sowohl die Migration als auch die Stammzelleigenschaften der Krebszellen. Verantwortlich hierfür ist die zunehmende Zelldichte und der Anstieg der HER2-Aktivierung, die letztlich das gesteigerte Wachstum verursacht. Die Tumorzelldichte und sogenannte microRNAs sorgen dafür, dass der Rezeptor für Progesteron von der Oberfläche der Zelle verschwindet. Den Regensburger Forschern zufolge lassen sich im Mausmodell 80 % der gebildeten Metastasen auf frühe Gewebeveränderungen zurückführen. Sie sind davon überzeugt, dass ihre hauptsächlich am Tiermodell gewonnenen Ergebnisse auch für humane Metastasen gelten.
Die New Yorker Wissenschaftler beschäftigen sich seit Jahren mit der Untersuchung eines Signalwegs, der möglicherweise eine zentrale Rolle bei der sogenannten »Tumour dormancy« spielt, dem p38-Signalweg. Denn nicht selten kommt es nach einer Operation und dem Verstreichen einer Latenzphase zu einem erneuten Auftreten der Erkrankung. Sie hatten diesen Signalweg im Zusammenhang mit der sogenannten »Epithelial-Mesenchymalen Transition« (EMT) untersucht, die es Zellen von Drüsenorganen wie der Brustdrüse erlaubt, sich von stationären in mobile Zellen umzuwandeln. Dabei führt ein Wechselspiel des Tumor-Suppressor-Gens p38 und des Onkogens HER2 zu der frühen Streuung von Brustkrebszellen. Denn im Laufe der Brustentwicklung werden p38, HER2 und die EMT abwechselnd an und ausgeschaltet. So fanden auch die New Yorker Forscher deutliche Hinweise darauf, dass die Tumorzellen einen Prozess für ihre Metastasierung missbrauchen, der für die Brustentwicklung und die Veränderungen während der Schwangerschaft von zentraler Bedeutung ist.
Die Ergebnisse der beiden Gruppen könnten auch erklären, warum man bei rund 5 % der Krebspatienten zwar Metastasen entdeckt, aber keinen Primärtumor: Sie könnten das Ergebnis einiger zufällig entstandener Krebszellen sein, die den Ort ihres Entstehens frühzeitig verlassen haben und an einem anderen Ort besser überleben konnten, als ihre am Ursprungsort verbliebenen Geschwisterzellen.
Die Forscher hoffen, dass ihre Erkenntnisse dabei helfen den Prozess der Metastasierung besser zu verstehen. Demzufolge durchlaufen Krebszellen zunächst bei geringer Zelldichte eine frühe Streuphase, die später in eine Wachstumsphase bei hoher Zelldichte übergeht. Doch laut dem Regensburger Forscherteam können auch Tumorzellen später Stadien wieder »lernen« zu streuen, wenn sie in niedriger Zelldichte vorliegen. Demnach können Metastasen aus verschiedenen Phasen der Tumorevolution stammen, sowohl aus frühen, wie aus späten Stadien. »Da diese Stadien auch genetisch unterschiedliche Zellen umfassen und moderne Therapien häufig an genetischen Veränderungen ansetzen, müssen Therapieansätze, die auf die Eliminierung der metastatischen Aussaat zielen, diese Heterogenität der Zellen berücksichtigen, um erfolgreich zu sein«, fasst Klein zusammen.
Fraunhofer-Institut für Toxikologie und Experimentelle Medizin, 14. Dezember 2016
Originalpublikation:
Hedayatollah Hosseini et al. Early dissemination seeds metastasis in breast cancer. Nature (2016) doi:10.1038/nature20785
Kathryn L. Harper et al. Mechanism of early dissemination and metastasis in Her2+ mammary cancer. Nature (2016), doi:10.1038/nature20609

