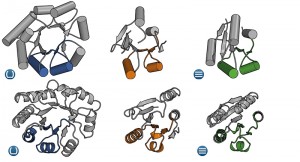
Auf den ersten Blick erscheinen Proteine mit Fass- (links) und Sndwich-artiger Faltung (rechts) völlig unterschiedlich. Analysen der Aminosäure-Sequenz sowie eine neu identifizierte Zwischenform (Mitte) lassen jedoch Ähnlichkeiten erkennen, die auf einen gemeinsamen evolutionären Ursprung hindeuten.
© MPI f. Entwicklungsbiologie/ B. Höcker
Ähnlichkeiten zwischen Proteinen beweisen, dass ihre große Vielfalt aus kleineren Bausteinen entstanden ist.
Proteine verleihen der Zelle Form und Stabilität, halten den Stoffwechsel am Laufen und übertragen Signale. Damit sie diese mannigfaltigen Aufgaben ausüben können, besitzen sie komplexe dreidimensionale Formen. Wissenschaftler vom Max-Planck-Institut für Entwicklungsbiologie in Tübingen haben nun herausgefunden, dass Proteine aus ähnlichen Aminosäure-Ketten aufgebaut sein können, selbst wenn sich ihre dreidimensionale Form deutlich unterscheidet. Das deutet darauf hin, dass die heute existierenden Proteine aus gemeinsamen Vorläufern entstanden sind. Vermutlich wurden sie im Laufe der Evolution nach dem Baukastenprinzip aus kleinen Fragmenten zusammengefügt.
Proteine bestehen aus langen Ketten mit 20 verschiedenen Aminosäure-Bausteinen, die sich zu einer charakteristischen dreidimensionalen Struktur falten. Auffällig ist dabei, dass einzelne Module, so genannte Protein-Domänen, häufiger vorkommen als andere. Wissenschaftler vermuten, dass viele dieser Domänen einen gemeinsamen evolutionären Ursprung haben.
Um diese Annahme zu überprüfen, haben die Max-Planck-Forscher zwei große und evolutionär alte Proteingruppen unter die Lupe genommen, die sich in ihrem Faltungsmuster deutlich unterscheiden. Während sich Protein-Domänen mit „Flavodoxin-ähnlicher“ Faltung zu einer Art Sandwich zusammenklappen, lagern sich bei den so genannten (βα)8-barrel-Proteinen zwei Sandwich-Elemente zu einer fassartigen Struktur zusammen. „Im gefalteten Zustand lassen sich zwischen diesen beiden Faltungstypen kaum Ähnlichkeiten erkennen“, erklärt José Arcadio Farías-Rico, Erstautor der Studie. Die Tübinger Wissenschaftler haben deshalb in einer Computeranalyse die Aminosäure-Ketten von über tausend Vertretern beider Faltungstypen verglichen. Dabei zeigte sich, dass bei beiden Faltungstypen kurze, charakteristische Abschnitte in der Abfolge der Aminosäuren auftreten.
Im nächsten Schritt identifizierte das Team einen dritten Faltungstypen, dessen Aminosäure-Sequenz eine Zwischenform der beiden anderen darstellt. Für den Vergleich der Aminosäuresequenzen haben die Wissenschaftler eine hoch-sensitive Methode benutzt, bei der sie auch kleinste Gemeinsamkeiten identifizieren können. „Die Analyse des dreidimensionalen Aufbaus der Zwischenform per Röntgenkristallografie hat ergeben, dass die Zwischenform sowohl Merkmale des Fass- als auch des Sandwich-artigen Faltungstyps besitzt“, so Farías-Rico.
Die Ähnlichkeit der Aminosäure-Sequenzen sowie die Existenz einer Zwischenform bestätigen die Hypothese von Birte Höcker, Leiterin der Arbeitsgruppe Protein Design am Tübinger Max-Planck-Institut für Entwicklungsbiologie. Demnach haben sich beide Faltungstypen im Laufe der Evolution aus einem gemeinsamen Vorläufer entwickelt. „Wir gehen davon aus, dass evolutionär frühe Proteine lediglich aus kurzen Aminosäure-Ketten bestanden. Diese Fragmente haben sich dann wie in einem Baukasten aneinandergefügt. So sind neue Moleküle mit neuen Funktionen entstanden“, erläutert Höcker.
Höckers Team hat damit nicht nur grundlegende Erkenntnisse über die Evolution moderner Proteine und die Ursprünge des Lebens auf der Erde gefunden. Die Max-Planck-Wissenschaftlerin forscht auch auf dem Gebiet der Synthetischen Biologie und will das Wissen nutzen, um im Labor Proteinvarianten mit neuen Funktionen herzustellen.
Forschungsmeldung der Max-Planck-Gesellschaft vom 15 Juli 2014.
José Arcadio Farías-Rico, Steffen Schmidt, Birte Höcker. Evolutionary relationship of two ancient protein superfolds. Nature Chemical Biology, 14. Juli 2014, DOI 10.1038/NCHEMBIO.1579

