Menschliches Herz. © Patrick J. Lynch. CC BY 2.5
Nach einem Herzinfarkt sterben Teile des Herzmuskels ab und werden durch eine Bindegewebsnarbe ersetzt. Deren Ausprägung und Stabilität ist entscheidend für das Überleben von Patienten mit einem akuten Herzinfarkt. Wissenschaftler haben nun mit Reg3beta ein Protein entdeckt, das für diese Form der Wundheilung im geschädigten Herzen eine wichtige Rolle spielt.
Eine akute Durchblutungsstörung des Herzmuskels, wie sie beim Herzinfarkt vorkommt, kann für das betroffene Herzareal dramatische Konsequenzen haben: Gelingt es den Ärzten nicht, innerhalb von wenigen Stunden den Verschluss des Blutgefäßes aufzulösen, sterben die von der Mangeldurchblutung betroffenen Muskelzellen ab. Dies hat für den Patienten fatale Folgen, da beim Menschen einmal verlorengegangenes Herzmuskelgewebe nicht wieder hergestellt werden kann. Die Pumpleistung des Herzens bleibt zeitlebens reduziert. Bei c.a. 25% aller Herzinfarkte treten jedoch nur geringe oder gar keine Beschwerden auf. Dann spricht man von einem sogenannten stummen Infarkt.
Bleibt die Mangeldurchblutung länger bestehen, so finden im geschädigten Teil des Herzmuskels zahlreiche Umbauprozesse statt. Dabei wird das abgestorbene Muskelgewebe durch Narbengewebe ersetzt. Experten sprechen in diesem Falls von Wundheilung, selbst wenn das Herz am Ende dieses Prozesses nicht wieder voll funktionsfähig ist. „Ohne diesen Umbau würde das Herz früher oder später zerreißen. Für die mittel- und langfristige Prognose der Infarktpatienten ist deshalb ein optimaler Ablauf von Wundheilung und Narbenbildung von Bedeutung“, sagt Jochen Pöling, Arzt und Wissenschaftler am Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim.
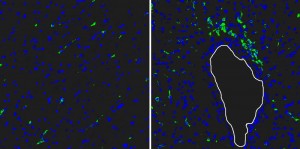
Reg3beta lockt weiße Blutkörperchen ins Infarktgebiet: Nach der Injektion von Reg3beta sind viel mehr grün eingefärbte Makrophagen in das Infarktgewebe eingewandert (rechts) als ohne Injektion (links). Zellkerne verschiedener Zellen sind blau gefärbt (weiße Linie: Blutgefäß).
© MPI f. Herz- und Lungenforschun
An einem Mausmodell haben die Forscher nun die Grundlagen des Heilungsprozesses im geschädigten Herzen näher untersucht und dabei herausgefunden, dass hierbei dem Immunsystem eine zentrale Rolle zukommt. „Bereits wenige Stunden nach einem Infarkt wandern weiße Blutkörperchen in den geschädigten Muskel ein. Zunächst sind es Granulozyten, die vor allem abgestorbene Herzmuskelzellen beseitigen. Im weiteren Verlauf wandern dann die als Makrophagen bezeichneten Fresszellen des Immunsystems ein. Unsere Daten zeigen, dass vor allem die Makrophagen für einen koordinierten und optimalen Heilungsverlauf besonders wichtig sind“, so Holger Lörchner, Erstautor der Studie.
Die Forscher untersuchten in ihrer Studie viele hundert Proteine, die von überlebenden Herzmuskelzellen ausgeschüttet werden. Dabei wurden sie auf das Protein Reg3beta aufmerksam. In weiteren Experimenten kristallisierte sich heraus, dass Reg3beta Makrophagen anlockt und gezielt deren Einwanderung in das beschädigte Gewebe fördert. „Bei Mäusen, denen das Reg3beta-Gen fehlte, wanderten viel weniger Immunzellen in das Infarktgebiet ein“, sagt Lörchner. Bei diesen Mäusen ist die Wundheilung gestört, mit fatalen Konsequenzen für das Überleben der Tiere: „Im Vergleich zur Kontrollgruppe mit normaler Reg3beta-Aktivität beobachteten wir bei den Tieren ohne Reg3beta wesentlich häufiger eine Ruptur des Herzens. Das Herz zerreißt regelrecht.“
Die Forscher schließen aus ihren Experimenten, dass Reg3beta eine Schlüsselfunktion bei der Regulation der Wundheilung spielt. „Infolge der verminderten Einwanderung von Makrophagen beobachteten wir einen gestörten Wundheilungsverlauf. So entwickelte sich bei Mäusen ohne Reg3beta das Bindegewebe wesentlich schlechter. Außerdem bildeten sich in der Infarktregion viel weniger neue Blutgefäße. Unterm Strich führte dies zu einer instabilen Narbe“, sagt Pöling.
In einem weiteren Experiment gelang es den Forschern bei den Mäusen ohne Reg3beta, die negativen Effekte, die durch dessen Mangel hervorgerufen wurden, zu kompensieren. Dazu injizierten sie künstlich hergestelltes Reg3beta direkt in das Narbengewebe. In der Folge verlief die Wundheilung weitestgehend normal. „Wir werden deshalb jetzt untersuchen, ob Reg3beta ein potenzieller Kandidat für eine Anwendung beim akuten Myokardinfarkt zur Verbesserung von Heilungsvorgängen im geschädigten Herzmuskel sein könnte“, so Thomas Braun, Direktor am Max-Planck-Institut. Die Hoffnung ist, mit einer Reg3beta-Therapie die Stabilität des Herzens zu verbessern und mögliche Spätfolgen wie die Herzinsuffizienz abmildern zu können.
Unterschiede in der Menge des gebildeten Reg3beta könnten möglicherweise die Ursache dafür sein, warum Infarkte bei manchen Betroffenen kaum oder gar keine Symptome verursachen, während andere Patienten massive Probleme bekommen. (Anmerkung der Redaktion von Scimondo)
Max-Planck-Gesellschaft, 20. März 2015
Originalpublikation:
Holger Lörchner, Jochen Pöling, Praveen Gajawada, Yunlong Hou, Viktoria Polyakova, Sawa Kostin, Juan M Adrian-Segarra, Thomas Böttger, Astrid Wietelmann, Henning Warnecke, Manfred Richter, Thomas Kubin, Thomas Braun. Myocardial healing requires Reg3β-dependent accumulation of macrophages in the ischemic heart. Nature Medicine (2015) doi:10.1038/nm.3816

